रुबिडियम
| रुबिडियम / Rubidium रासायनिक तत्व | |
 रूबिडियम का एक नमूना
| |
| रासायनिक चिन्ह: | Rb |
| परमाणु संख्या: | ३७ |
| रासायनिक शृंखला: | क्षार धातु |
 आवर्त सारणी में स्थिति
| |
 | |
| अन्य भाषाओं में नाम: | Rubidium (अंग्रेज़ी) |
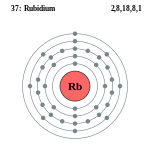
रूबिडियम (Rubidium) एक रासायनिक तत्व है। यह आवर्त सारणी के प्रथम मुख्य समूह का चौथा तत्व है। अन्य क्षार धातुओं की तरह यह अत्यधिक प्रतिक्रियाशील है, अतः वातावरण में नमी के साथ इसकी अभिक्रिया को रोकने के लिए इसे एक कांच के एम्प्यूल में रखा जाता है। इसमें धातुगुण वर्तमान हैं। इसके तीन स्थिर समस्थानिक प्राप्त हैं, जिनकी द्रव्यमान संख्याएँ क्रमश: ८५, ८६, ८७ हैं। इस तत्व की खोज बुंसन तथा किर्खहॉफ़ ने १८६० ई. में स्पेक्ट्रमदर्शी (spectroscope) द्वारा की थी। स्पेक्ट्रमदर्शी द्वारा प्रयोगों में दो नई लाल रेखाएँ मिलीं, जिनके कारण इसका नाम 'रूबिडियम' रखा गया।
लेपिडोलाइट अयस्क में रूबिडियम की मात्रा लगभग १ प्रतिशत रहती है। इसके अतिरिक्त अभ्रक तथा कार्टेलाइड में भी यह न्यून मात्रा में मिलता है। पोटैशियम तथा रूबिडियम के प्लैटिनिक क्लोराइडों की विलेयता भिन्न भिन्न है, जिसके कारण इन दोनों को पृथक् किया जा सकता है।
गुणधर्म[संपादित करें]
रूबिडियम के यौगिकों को कैल्सियम अथवा विद्युत् द्वारा अपचयित कराकर धातु प्राप्त की जाती है। यह चमकदार धातु है।[1] इसके गुण ये है :
- संकेत : Rb
- परमाणुसंख्या ३७,
- परमाणुभार ८५.४७,
- गलनांक ३८.९ सें.,
- क्वथनांक ६८८ सें. तथा
- घनत्व १.५३ ग्राम प्रति घन सेंमी.।
रूबिडियम की वायु में शीघ्र ऑक्सीकरण हो जाता है। यह जल का शीघ्रता से विघटन करता है। इसके लवण रंगहीन तथा जलविलेय हैं और इनके गुण प्राय: पोटैशियम लवणों से मिलते जुलते हैं।
इन्हें भी देखें[संपादित करें]
सन्दर्भ[संपादित करें]
- ↑ Ohly, Julius (1910). "Rubidium". Analysis, detection and commercial value of the rare metals. Mining Science Pub. Co.
