ताम्र
| ताम्र / Copper रासायनिक तत्व | |
 | |
| रासायनिक चिन्ह: | Cu |
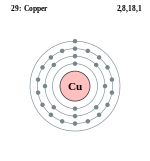
| परमाणु संख्या: | 29 |
| रासायनिक शृंखला: | संक्रमण धातु |
 आवर्त सारणी में स्थिति
| |
 | |
| अन्य भाषाओं में नाम: | Copper (अंग्रेज़ी), Медь (रूसी), 銅 (जापानी) |
ताँबा या ताम्र (अंग्रेज़ी - Copper) एक भौतिक तत्त्व है। इसका संकेत Cu है। इसकी परमाणु संख्या 29 और परमाणु भार 63.5 है। यह एक तन्य धातु है जिसका प्रयोग विद्युत के चालक के रूप में प्रधानता से किया जाता है।
मानव सभ्यता के इतिहास में तांबे का एक प्रमुख स्थान है क्योंकि प्राचीन काल में मानव द्वारा सबसे पहले प्रयुक्त धातुओं और मिश्रधातुओं में तांबा और कांसे (जो कि तांबे और टिन से मिलकर बनता है) का नाम आता है।
समस्थानिक
[संपादित करें]कम क्षयशील समस्थानिक 63 तथा 65 के अलावा तांबे के कोई 2 दर्जन समस्थानिक हैं जो क्षयशील (रेडियोसमस्थानिक) हैं।
गुण
[संपादित करें]तांबा धातु विद्युत तथा उष्मा का सुचालक है। इस सुचालकता की श्रेणी में यह चाँदी के बाद दूसरे क्रम पर आता है। इसमें एक लालिमा जैसी चमक होती है। यह सामान्यतः जल से अभिक्रिया नहीं करता है पर वायव्य जारक से धीरे धीरे संयोग कर ऑक्साईड बनाता है। लेकिन लोहे में जंग लगने से बिल्कुल अलग इसका ऑक्साईड धातु के ऊपर एक परत बनाता है जो इसके और ऑक्सीकरण को रोकता है। यह परत स्टैच्यू ऑफ़ लिबर्टी (न्यूयॉर्क) पर भी देखी जा सकती है। तांबे के पात्र में दूध नहीं रखा जाता ।
निष्कर्षण
[संपादित करें]तांबे के प्रमुख अयस्कों में तांबा ग्लांस (Cu2S), ताम्र पाइराइट्स (CuFeS2), क्यूप्राइट (Cu2O) तथा मैकेलाईट (Cu(OH)2.CuCO3) के नाम आते हैं। पहले फेन प्लावन विधि से अयस्क का सांद्रण कर लिया जाता है। सांद्रित अयस्क को महीन चूर्ण करके उसे एक परवर्तनी भट्ठी में वायु प्रवाह की उपस्थिति में भर्जित करते हैं। इस प्रक्रिया द्वारा क्यूप्रस सल्फाईड (Cu2S) और फेरस सल्फाईड (FeS) का मिश्रण प्राप्त होता है। अशुद्धियाँ आक्सीकृत होकर निल जाती हैं।
इसके बाद इसे कोक के साथ वात्या भट्ठी में गर्म करते हैं जिससे फेरस सल्फाईड फेरस ऑक्साईड बनाता है तथा सिलिका के साथ अभिक्रिया करके धातुमल (फेरस सिलिकेट) बनाता हुआ निकल जाता है। इसके बाद इस को एक भट्ठी में गर्म करते हैं तो तांबे के सल्फाईड पहले आक्साइड में बदल जाते हैं तथा फिर बचे हुए सल्फाइड से अभिक्रिया करके सल्फर डाई ऑक्साईड तथा तांबा देते हैं।
इस क्रिया से लगभग 99.99% ताँबा प्राप्त होता है|
- 2Cu2S + 3 O2 → 2Cu2O + 2 SO2
- 2Cu2O + Cu2S → 6Cu + SO2
चित्रावली
[संपादित करें]-
Ankh, symbol for copper
-
alchemical/planetary symbol for copper
-
Prášková měď
-
Fosforečnan měďnatý - Cu3(PO4)2
-
Oxid měďnatý - CuO
-
Foods rich in copper
-
Flame test on copper sulphate
-
Flame test on copper sulphate seen through cobalt glass
-
The flame test carried out on a copper halide.
ताम्र निष्कर्षण
[संपादित करें]-
Crystals of native copper
-
Mineral copper
-
Native copper
-
Native copper etched to show crystals
-
Cuprite (copper ore)
-
Dissolved copper from deep underground cools to form the Primary orebody
-
Air or water oxidizes some of the orebody
-
Water enriches copper below the oxidized zone creating Secondary enrichment zone (violet)
-
The El Chino open-pit copper mine in New Mexico.
-
Coppermine Chuquicamata, Chile






























