"एसिटिक अम्ल": अवतरणों में अंतर
नया पृष्ठ: {{PAGENAME}} एक कार्बनिक यौगिक है। श्रेणी:कार्बनिक यौगिक |
Translated from http://en.wikipedia.org/wiki/Acetic_acid (revision: 359586630) using http://translate.google.com/toolkit with about 96% human translations. |
||
| पंक्ति 1: | पंक्ति 1: | ||
{{Refimprove|date=December 2009}} |
|||
{{PAGENAME}} एक [[कार्बनिक यौगिक]] है। |
|||
{{featured article}} |
|||
[[श्रेणी:कार्बनिक यौगिक]] |
|||
{{chembox |
|||
| Watchedfields = changed |
|||
| verifiedrevid = 325605219 |
|||
| ImageFileL1 = Acetic-acid-2D-skeletal.svg |
|||
| ImageNameL1 = Skeletal structure |
|||
| ImageSizeL1 = 120px |
|||
| ImageFileR1 = Acetic_acid_flat_structure.png |
|||
| ImageNameR1 = Flat structure |
|||
| ImageSizeR1 = 150px |
|||
| ImageFileL2 = Acetic-acid-CRC-GED-3D-balls-B.png |
|||
| ImageNameL2 = Ball-and-stick model |
|||
| ImageSizeL2 = 120px |
|||
| ImageFileR2 = Acetic-acid-CRC-GED-3D-vdW-B.png |
|||
| ImageNameR2 = Space-filling model |
|||
| ImageSizeR2 = 120px |
|||
| IUPACName = Ethanoic acid |
|||
| SystematicName = Acetic acid |
|||
| OtherNames = Acetyl hydroxide (AcOH), Hydrogen acetate (HAc), Ethylic acid, Methanecarboxylic acid |
|||
| Section1 = {{Chembox Identifiers |
|||
| InChIKey = QTBSBXVTEAMEQO-UHFFFAOYAR |
|||
| CASNo = 64-19-7 |
|||
| CASNo_Ref = {{cascite}} |
|||
| ChemSpiderID = 171 |
|||
| PubChem = 176 |
|||
| SMILES = O=C(O)C |
|||
| InChI = 1/C2H4O2/c1-2(3)4/h1H3,(H,3,4) |
|||
}} |
|||
| Section2 = {{Chembox Properties |
|||
| C = 2|H = 4|O = 2 |
|||
| Appearance = colorless liquid |
|||
| Density = 1.049 g/cm<sup>3</sup> ([[liquid|l]])<br /> 1.266 g/cm<sup>3</sup> ([[solid|s]]) |
|||
| Solubility = Fully [[miscible]] |
|||
| MeltingPtC = 16.5 |
|||
| BoilingPtC = 118.1 |
|||
| Equilibrium K<sub>a</sub> = 1.8*10<sup>-5</sup> |
|||
| pKa = 4.76 at 25 °C |
|||
| Viscosity = 1.22 [[pascal second|mPa·s]] at 25 °C |
|||
}} |
|||
| Section3 = {{Chembox Structure |
|||
| Dipole = 1.74 [[Debye|D]] (gas) |
|||
}} |
|||
| Section7 = {{Chembox Hazards |
|||
| EUIndex = |
|||
| EUClass = Corrosive ('''C''')<br />Flammable ('''F''') |
|||
| NFPA-H = 2 |
|||
| NFPA-F = 2 |
|||
| NFPA-R = 2 |
|||
| FlashPt = 43 °C |
|||
| RPhrases = {{R10}}, {{R35}} |
|||
| SPhrases = {{S1/2}}, {{S23}}, {{S26}}, {{S45}} |
|||
| LD50 = 3310 mg/kg, oral (rat) |
|||
}} |
|||
| Section8 = {{Chembox Related |
|||
| Function = [[carboxylic acid]]s |
|||
| OtherFunctn = [[Formic acid]]<br />[[Propionic acid]] |
|||
| OtherCpds = [[Acetamide]], [[Ethyl acetate]], [[Acetyl chloride]], [[Acetic anhydride]], [[Acetonitrile]], [[Acetaldehyde]], [[Ethanol]], [[Thioacetic acid]], [[sodium acetate]], [[potassium acetate]] |
|||
}} |
|||
}} |
|||
एसिटिक अम्ल CH<sub>3</sub>COOH जिसे '''एथेनोइक अम्ल''' के नाम से भी जाना जाता है, एक [[कार्बनिक अम्ल]] है जिसकी वजह से [[सिरका]] में खट्टा स्वाद और तीखी खुशबू आती है. यह इस मामले में एक [[कमज़ोर अम्ल]] है कि इसके [[जलीय विलयन]] में यह अम्ल केवल आंशिक रूप से [[विभाजित]] होता है. शुद्ध, [[जल]] रहित एसिटिक अम्ल (''ठंडा एसिटिक अम्ल'' ) एक रंगहीन [[तरल]] होता है, जो वातावरण ([[हाइग्रोस्कोपी]]) से जल सोख लेता है और 16.5 [[°C]] (62 [[°F]]) पर जमकर एक रंगहीन [[क्रिस्टलीय]] [[ठोस]] में बदल जाता है. शुद्ध अम्ल और उसका सघन विलयन खतरनाक संक्षारक होते हैं. |
|||
एसिटिक अम्ल एक सरलतम [[कार्बोक्जिलिक अम्ल]] है. ये एक महत्वपूर्ण [[रासायनिक अभिकर्मक]] और औद्योगिक रसायन है, जिसे मुख्य रूप से शीतल पेय की बोतलों के लिए [[पोलिइथाइलीन टेरिफ्थेलेट]]; [[फोटोग्राफिक फिल्म]] के लिए [[सेलूलोज़ एसिटेट]], लकड़ी के [[गोंद]] के लिए [[पोलिविनाइल एसिटेट]] और सिन्थेटिक फाइबर और कपड़े बनाने के काम में लिया जाता है. घरों में इसके तरल विलयन का उपयोग अक्सर एक [[डिस्केलिंग एजेंट]] के तौर पर किया जाता है. [[खाद्य उद्योग]] में एसिटिक अम्ल का उपयोग [[खाद्य संकलनी कोड]] E260 के तहत एक [[एसिडिटी नियामक]] और एक मसाले के तौर पर किया जाता है. |
|||
एसिटिक अम्ल की वैश्विक मांग क़रीब 6.5 मिलियन [[टन]] प्रतिवर्ष(Mt/a) है, जिसमें से क़रीब 1.5 Mt/a प्रतिवर्ष पुनर्प्रयोग या रिसाइक्लिंग द्वारा और शेष [[पेट्रोरसायन]] फीडस्टोक्स या जैविक स्रोतों से बनाया जाता है. स्वाभाविक किण्वन द्वारा उत्पादित जलमिश्रित एसिटिक अम्ल को [[सिरका]] कहा जाता है. |
|||
==नामकरण== |
|||
''एसिटिक अम्ल'' का [[साधारण नाम]] [[लेटिन]] शब्द ''एसिटम'' से व्युत्पन्न है, जो [[सिरका]] के लिए प्रयोग किया जाता है और जो [[wikt:acid|अम्ल]] शब्द से संबंध रखता है. इसका पर्यायवाची शब्द ''इथेनोइक अम्ल'' IUPAC के स्थानापन्न नामकरण के अनुसार किया गया है. |
|||
जल रहित एसिटिक अम्ल का एक छोटा नाम '''ग्लेशियल एसिटिक अम्ल''' है. घरेलु तापमान 16.7 डिग्री सेल्सियस(62 डिग्री फारेनहाईट) से जरा से कम तापमान पर बनने वाले बर्फ के जैसे क्रिस्टलों के [[जर्मन]] नाम ''ऐसेस्सिग'' (शाब्दिक रूप से हिम-सिरका) से भी ये नाम समानता रखता है. |
|||
एसिटिक अम्ल के लिए सबसे आम संक्षिप्त नाम HOAc है जहां Ac [[एसिटाइल]] [[वर्ग]] CH<sub>3</sub>−C(=O) को दर्शाता है. [[अम्ल आधारित क्रियाओं]] के संदर्भ में अक्सर संक्षिप्तिकरण ''HAc'' उपयोग में लिया जाता है जहां ''Ac'' [[एसिटेट]] [[ऋणायन]](CH<sub>3</sub>COO<sup>−</sup>, संक्षिप्त रूप में ''AcO'' <sup>−</sup>), को इंगित करता है, हालांकि ये उपयोग अक्सर भ्रामक माना जाता है. दूसरे मामलों में [[रासायनिक तत्व]] [[एक्टिनियम]] के संक्षिप्तिकरण के साथ ''Ac'' को जोड़ के भ्रमित नहीं होना चाहिए. |
|||
एसिटिक अम्ल का [[प्रयोगमिश्रित सूत्र]] C<sub>2</sub>H<sub>4</sub>O<sub>2</sub> है. सोडियम एसिटेट लवण के निर्माण में सक्रिय हाइड्रोजन की भूमिका पर ज़ोर देने के लिए कुछ लोग इसका आण्विक सूत्र HC<sub>2</sub>H<sub>3</sub>O<sub>2</sub> रूप में लिखते हैं. <ref name="akeroyd">{{cite journal|first = F. Michael|last = Akeroyd|year = 1993|title = Laudan's Problem Solving Model|journal = The British Journal for the Philosophy of Science|volume = 44|issue = 4|pages = 785–88|doi = 10.1093/bjps/44.4.785}}</ref> इसकी संरचना को बेहतर तरीके से दर्शाने के लिए एसिटिक अम्ल को प्राय: CH<sub>3</sub>-CO<sub>2</sub>-H, CH<sub>3</sub>COOH, या CH<sub>3</sub>CO<sub>2</sub>H लिखा जाता है. <sub>ion</sub> एसिटिक अम्ल से हाइड्रोजन धनायन [[H+|H<sup>+</sup>]] के निकलने से ''एसिटेट'' ऋणायन बनता है. ''एसिटेट'' नाम का उल्लेख इस ऋणायन से बनने वाले [[लवण]] या एसिटिक अम्ल के एक [[एस्टर]] के लिए कर सकते हैं. |
|||
==इतिहास== |
|||
पुरातन सभ्यता में [[सिरका]] को, [[बीयर]] और [[वाइन]] के हवा के संपर्क में आने का प्राकृतिक परिणाम माना जाता था क्योंकि, एसिटिक अम्ल उत्पन्न करने वाले जीवाणु पूरे विश्व में मौजूद हैं. |
|||
[[रसायन विद्या]] में एसिटिक अम्ल का उपयोग ई. पू. तीसरी शताब्दी में भी किया जाता था, जब [[ग्रीक]] दार्शनिक [[थियोफ्रेसस]] ने बताया कि कैसे सिरका और धातुओं की क्रिया से कला में उपयोगी [[रंगों]], ''सफेद सीसा'' ([[लेड कार्बोनेट]]) और ''[[वर्डिग्रीस]]'' , [[कॉपर(II) एसिटेट|[[कॉपर]](II) एसिटेट]] समेत ताम्र लवणों के हरे मिश्रण का निर्माण होता है. प्राचीन [[रोम]] में कड़वी वाइन को सीसे के बर्तनों में उबाल कर एक बहुत ही मीठा शर्बत ''सापा'' बनाया जाता था. सापा [[लेड एसीटेट]] से भरपूर था, जोकि एक मीठा पदार्थ था, जिसे की ''सीसे की शक्कर '' या [[साटम|''साटम'' ]] की चीनी कहा जाता था और जिसने रोमन कुलीन तंत्र में सीसे का [[ज़हर फैलाने]] में भागीदारी निभाई. <ref name="martin">{{cite book|last = Martin|first = Geoffrey|year = 1917|title = Industrial and Manufacturing Chemistry|edition = Part 1, Organic|location = London|publisher = Crosby Lockwood|pages=330–31}}</ref> |
|||
[[मुस्लिम कीमियागर]] [[जबीर इब्न हय्यान(गैबर)]] ने 8वीं सदी में पहली बार [[आसवन]] द्वारा सिरका से एसिटिक अम्ल अलग किया. [[पुनर्जागरण]] के समय कुछ धातु एसिटेट(मुख्य रूप से कॉपर(II) एसिटेट) के [[सूखे आसवन]] से ग्लेशियल एसिटिक अम्ल बनाया गया. 16वीं शताब्दी में [[जर्मन]] कीमियागर [[एन्ड्रीस लिबावियस]] ने ऐसी ही एक विधी का वर्णन किया और उसने इस तरह से बने ग्लेशियल एसिटिक अम्ल की तुलना सिरका से बने अम्ल से की. सिरका में जल की मौजूदगी से एसिटिक अम्ल के गुणों पर इतना गहरा प्रभाव पड़ता है कि सदियों तक रसायनशास्त्री ग्लेशियल एसिटिक अम्ल और सिरका से बने अम्ल को दो अलग पदार्थ मानते रहे. फ्रांसिसी रसायनशास्त्री [[पियरे एडेट]] ने उन्हे समान साबित किया. <ref name="martin"></ref> |
|||
[[File:AceticAcid012.jpg|upright|thumb|सघन एसिटिक एसिड]] |
|||
1847 में जर्मन रसायनज्ञ [[हरमन कोल्बे]] ने पहली बार [[अकार्बनिक]] पदार्थों से एसिटिक अम्ल [[संश्लेषित]] किया. इस क्रिया अनुक्रम में [[कार्बन डीसल्फाइड]] के [[क्लोरीनीकरण]] से [[कार्बन टेट्राक्लोराइड]], फिर [[पायरोलिसिस]] से [[टेट्राक्लोरोइथेली]]न और जलीय क्लोरीनीकरण से [[ट्राइक्लोरोएसिटिक अम्ल]] और अन्त में [[वैद्युत]] [[अपघटन]] से एसिटिक अम्ल का निर्माण होता है. <ref name="goldwhite">{{cite journal|url = http://membership.acs.org/N/NewHaven/bulletins/Bulletin_2003-09.pdf|last = Goldwhite|first = Harold|journal = New Haven Section Bull. Am. Chem. Soc.|volume = 20|issue = 3| month = September|year = 2003|title = Short summary of the career of the German organic chemist, Hermann Kolbe|format=PDF}}</ref> |
|||
1910 तक ज्यादातर ग्लेशियल एसिटिक अम्ल लकड़ी के आसवन द्वारा बने "पायरोलिग्नियस शराब" से बनाया जाता था. [[चूने के दूध]] के साथ क्रिया करा कर एसिटिक अम्ल को अलग किया जाता था और प्राप्त [[केल्सियम एसिटेट]] को [[सल्फ्यूरिक अम्ल]] से अम्लीयकृत करके एसिटिक अम्ल प्राप्त किया जाता था. उस समय जर्मनी 10 हज़ार [[टन]] ग्लैशियल एसिटिक अम्ल बना रही थी जो [[इंडिगो डाई]] के उत्पादन में प्रयुक्त एसिटिक अम्ल का करीब 30 प्रतिशत था. <ref name="martin"></ref><ref name="schweppe">{{cite journal|last = Schweppe|first = Helmut|year = 1979|url = http://aic.stanford.edu/jaic/articles/jaic19-01-003_1.html|title = Identification of dyes on old textiles|journal = J. Am. Inst. Conservation|volume = 19|issue = 1/3|pages=14–23|doi = 10.2307/3179569}}</ref> |
|||
==रासायनिक गुण== |
|||
[[File:AceticAcid010.png|thumb|upright|एसिटिक एसिड क्रिस्टल]] |
|||
कार्बोक्ज़िलिक अम्लों जैसे कि एसिटिक अम्ल के [[कार्बोक्जिल वर्ग]](−COOH) का हाइड्रोजन(H) परमाणु को H<sup>+</sup> आयन([[प्रोटोन]]) के रूप में छोड़ देने की क्षमता उन्हे अम्लीय गुण प्रदान करती है. एसिटिक अम्ल 4.75 [[pKa|pK<sub>a</sub>]] मूल्य के साथ एक कमजोर अम्ल है, क्योंकि ये जलीय विलयन में प्रभावी रूप से [[मोनोप्रोटिक अम्ल]] है. एसिटेट(CH<sub>3</sub>COO<sup>−</sup>) इसका [[संयुग्मी क्षार]] है. एक 1.0 [[M]] विलयन (घरेलू सिरका जैसी सघनता) का [[pH]] 2.4 होना ये दर्शाता है कि एसिटिक अम्ल के केवल 0.4% अणु ही विभाजित हुए हैं. |
|||
[[File:Acetic acid deprotonation.png|375px|एसिटिक एसिड के पानी में डीप्रोटोनेशन संतुलन ]] |
|||
[[File:Acetic acid cyclic dimer.png|thumb|एसिटिक एसिड का अस्पष्ट चक्रीय; डैश्ड रेखाएं हाइड्रोजन बांड का प्रतिनिधित्व करते हुए]] |
|||
एसिटिक अम्ल की क्रिस्टलीय संरचना दर्शाती है कि अणु [[हाइड्रोजन बंध]] द्वारा [[डायमरों]] में जोड़ा बना कर रहते हैं. <ref name="jones">{{cite journal|last = Jones|first = R.E.|coauthors = Templeton, D.H.|year = 1958|title = The crystal structure of acetic acid|journal = Acta Crystallogr.|volume = 11|issue = 7|pages=484–87|doi = 10.1107/S0365110X58001341}}</ref> 120 डिग्री सेल्सियस पर बनने वाली वाष्प में भी डायमरों का पता लगाया जा सकता है. गैर-हाइड्रोजन बंध वाले विलायकों में बने तरल विलयन में भी ये मौजूद होते हैं और कुछ मात्रा में शुद्ध एसिटिक अम्ल में भी, <ref name="briggs">{{cite journal|first = James M.|last = Briggs|coauthors = Toan B. Nguyen, William L. Jorgensen|title = Monte Carlo simulations of liquid acetic acid and methyl acetate with the OPLS potential functions|journal = J. Phys. Chem.|year = 1991|volume = 95|pages=3315–22|doi = 10.1021/j100161a065}}</ref> लेकिन हाइड्रोजन बंध वाले विलायकों में ये बाधित हो जाते हैं. डायमर की पृथक्करण तापीय धारिता 65.0–66.0 किलो जूल प्रति मोल और पृथक्करण उत्क्रम माप 154–157 J मोल <sup>−1</sup> K<sup>−1</sup> मापा गया है. <ref name="togeas">{{cite journal|first = James B.|last = Togeas|title = Acetic Acid Vapor: 2. A Statistical Mechanical Critique of Vapor Density Experiments|journal = J. Phys. Chem. A|year = 2005|volume = 109|pages = 5438|doi = 10.1021/jp058004j|pmid = 16839071|issue = 24}}</ref> दूसरे निचले कार्बोक्जिलिक अम्लों में भी ये डायमरीकरण पाया जाता है. |
|||
[[तरल]] एसिटिक अम्ल [[एथेनॉल]] और [[जल]] की तरह एक [[हाइड्रोफिलिक]]([[ध्रुवीय]]) [[प्रोटिक विलायक]] है. 6.2 की एक उदार [[तुलनात्मक स्थैतिक परमिटिविटी]](द्विवैद्युत स्थिरांक) के साथ ये न सिर्फ ध्रुवीय यौगिकों जैसे कि अकार्बनिक लवणों और [[शर्करा]] बल्कि अध्रुवीय यौगिकों जैसे तेल और [[सल्फर]] व [[आयोडीन]] जैसे [[अवयवों]] को भी घोल सकती है. ये ध्रुवीय और अध्रुवीय [[विलायकों]] जैसे जल, [[क्लोरोफॉर्म]] और [[हैक्सेन]] के साथ तत्काल मिश्रित हो जाती है. उच्च एल्केनों के साथ एसिटिक अम्ल ([[ऑक्टेन]] से शुरू होने वाले) पूरी तरह से नहीं मिल पाता है और मिलने की ये योग्यता लंबे n-एल्केनों के साथ घटती जाती है. <ref name="Zieborak">{{cite journal|first = K.|last = Zieborak|coauthors = K. Olszewski|journal = Bull.Acad.Pol.Sci.Ser.Sci.Chim.Geol.Geogr.|year = 1958|volume = 6|issue=2|pages=3315–22}}</ref> एसिटिक अम्ल का [[घुलने]] और मिलने का ये गुण इसे व्यापक तौर से इस्तेमाल किये जाने वाला औद्योगिक रसायन बनाता है. |
|||
===रासायनिक क्रियाएं=== |
|||
एसिटिक अम्ल [[लोहा]], [[मैग्नीशियम]] और [[ज़िंक]] समेत [[धातुओं]] के लिए [[संक्षारक]] है और [[हाइड्रोजन]] गैस बनाता है और धातु लवण जिन्हे एसिटेट कहा जाता है. [[एल्युमीनियम]] ऑक्सीज़न के संपर्क में आने पर इसकी सतह पर [[एल्यूमीनियम ऑक्साइड]] की एक पतली परत बनाता है जो कि तुलनात्मक रूप से अम्ल प्रतिरोधी होती है इसी कारण एसिटिक अम्ल का परिवहन एल्यूमीनियम टैंकों में किया जाता है. एसिटिक अम्ल और एक उचित [[क्षार]] से भी मैटल एसिटेट बनाए जा सकते हैं, जैसा की विख्यात "[[बेकिंग सोडा]] + सिरका" क्रिया में होता है. [[क्रोमियम(II) एसिटेट]] के उल्लेखनीय अपवाद को छोड़ कर बाकी सारे एसीटेट जल में विलयशील होते हैं. |
|||
: Mg([[s]]) + 2 CH<sub>3</sub>COOH([[aq]]) → (CH<sub>3</sub>COO)<sub>2</sub>Mg(aq) + H<sub>2</sub>([[g]]) |
|||
: NaHCO<sub>3</sub>(s) + CH<sub>3</sub>COOH(aq) → CH<sub>3</sub>COONa(aq) + CO<sub>2</sub>(g) + H<sub>2</sub>O([[l]]) |
|||
[[File:Acetic acid organic reactions.png|400px|एसिटिक एसिड के दो विशिष्ट जैविक प्रतिक्रियाएं]] |
|||
एसिटिक अम्ल, कार्बोक्जिलिक अम्ल की विशिष्ट [[रासायनिक अभिक्रियाओं]] से गुज़रता है जैसे [[एल्केली]] से क्रिया करते हुए [[पानी]] और एक धातु [[इथेनोएट]] बनाता है, एक धातु से क्रिया करके धातु इथेनोएट बनाता है और जब [[कार्बोनेटों]] तथा [[हाइड्रोजन कार्बोनेटों]] से क्रिया कराई जाए तो एक धातु इथेनोएट, जल तथा [[कार्बन डाइ ऑक्साइड]] बनाता है. इनमें सबसे उल्लेखनीय अभिक्रिया है न्यूनीकरण द्वारा [[इथेनॉल]] बनाना और [[न्यूक्लिओफिलिक एसिल प्रतिस्थापन]] द्वारा [[एसिटाइल क्लोराइड]] जैसे यौगिक बनाना. दूसरे प्रतिस्थापन यौगिकों में [[एसिटिक एनहाइड्राइड|एसिटिक [[एनहाइड्राइड]]]] शामिल है जो एसिटिक अम्ल के दो अणुओं में से [[जल के निकल जाने]] से बनता है. इसी तरह [[फिशर एस्टरीकरण]] द्वारा एसिटिक अम्ल के [[एस्टर]] और [[मध्यस्थ]] बनाए जा सकते हैं. 440°C से ऊपर गर्म करने पर एसिटिक अम्ल विघटित होकर [[कार्बन डाइ ऑक्साइड]] और [[मिथेन]] या जल और [[इथेनॉल]] बनाता है. |
|||
एसिटिक अम्ल अपनी विशेष गंध से पहचाना जा सकता है. एसिटिक अम्ल के लवणों के लिए एक [[रंगीन क्रिया]] है [[आयरन(III) क्लोराइड]] विलयन, जिसके परिणामस्वरूप गहरा लाल रंग बनता है जो अम्लीकरण के बाद गायब हो जाता है. [[आर्सेनिक ट्राइऑक्साइड]] के साथ गर्म किये जाने पर एसीटेट [[काकोडाइल ऑक्साइड]] बनाते हैं जिसका उसकी [[बदबूदार]] वाष्प के कारण पता लगाया जा सकता है. |
|||
===जीवरसायन=== |
|||
एसिटिक अम्ल से व्युत्पन्न [[एसिटाइल]] [[वर्ग]] जीवन के सभी रूपों के जैव रसायन का मौलिक आधार है. [[कोएन्ज़ाइम A]] के साथ बंध बनाने पर ये [[कार्बोहाइड्रेट]] और [[वसा]] के [[चयापचय]] का केंद्र बन जाता है. हालांकि कोशिकाओं के अवयवों के [[pH]] के नियंत्रण में बाधाओं से बचने के लिए कोशिकाओं में मुक्त एसिटिक अम्ल की सांद्रता को निचले स्तर पर रखा जाता है. लंबी श्रृंखला वाले कार्बोक्जिलिक अम्लों ([[मोटे अम्लों]]) की तरह एसिटिक अम्ल प्राकृतिक [[ट्राइग्लिसराइड]] में नहीं मिलता है. हालांकि कृत्रिम ट्राइग्लिसराइड [[ट्राइएसिटिन]] (ग्लिसरीन ट्राइएसिटेट) एक आम खाद्य योजक है और सौंदर्य प्रसाधन और सामयिक दवाओं में पाया जाता है. |
|||
एसिटिक अम्ल का उत्पादन और [[उत्सर्जन]] [[एसिटिक एसिड जीवाणुओं]] विशेषकर ''[[एसीटोबेक्टर]]'' जीनस और ''[[क्लोस्ट्रीडियम एसिटोब्यूटाइलिकम]]'' द्वारा किया जाता है. ये जीवाणु सार्वभौमिक रूप से [[खाद्य]] पदार्थों, [[जल]] और [[मिट्टी]] में पाये जाते हैं और फलों और दूसरे खाद्य पदार्थों के सड़ने से एसिटिक अम्ल का उत्पादन स्वाभाविक रूप से होता है. [[मनुष्यों]] और दूसरे [[स्तनपाइयों]] में एसिटिक अम्ल [[योनि स्नेहक]] का एक हिस्सा होता है, जहां कि ये एक हल्के [[एंटिबायोटि]]क एजेंट के रूप में कार्य करता है. |
|||
==उत्पादन== |
|||
[[File:Acetic acid 1884 plant.jpg|thumb|1884 में एसिटिक एसिड के लिए शोधन संयंत्र और सांद्रता ]] |
|||
एसिटिक अम्ल को कृत्रिम रूप से और जीवाणुओं के [[किण्वन]], दोनों तरीकों से उत्पादित किया जाता है. आज विश्व उत्पादन का लगभग 10 प्रतिशत जैविक मार्ग से बनाया जाता है लेकिन ये महत्वपूर्ण है क्योंकि कई देशों के खाद्य शुद्धता कानूनों की बाध्यता है कि खाद्य पदार्थों में प्रयुक्त होने वाला सिरका जैविक मूल का होना चाहिए, रसायन उद्योगों में प्रयुक्त होने वाले एसिटिक अम्ल का 75% मिथेनॉल कार्बोनाइलिकरण से बनाया जाता है जिसे नीचे समझाया गया है. शेष के लिए वैकल्पिक तरीकों का प्रयोग किया जाता है. <ref name="Yoneda2001">{{cite journal|author = Yoneda, N.|coauthors = Kusano, S.; Yasui, M.; Pujado, P.; Wilcher, S.|year = 2001|title = Recent advances in processes and catalysts for the production of acetic acid|journal = Applied Catalysis A, General|volume = 221|issue = 1-2|pages = 253–265|doi = 10.1016/S0926-860X(01)00800-6}}</ref> शुद्ध एसिटिक अम्ल का कुल वैश्विक उत्पादन 50 लाख टन प्रति वर्ष आंका गया है जिसका करीब आधा हिस्सा [[संयुक्त राज्य]] में उत्पादित होता है. [[यूरोपीय]] उत्पादन 1 Mt/a के करीब है जिसमें गिरावट आ रही है और [[जापान]] का उत्पादन 0.7 Mt/a प्रति वर्ष है. प्रतिवर्ष पुनर्नवीनीकरण से प्राप्त 1.5 Mt को मिलाकर विश्व बाजार में एसिटिक अम्ल का कुल उत्पादन 6.5 Mt/a है. <ref>{{cite journal|title = Production report|journal = Chem. Eng. News|publication-date = 11 July 2005|pages=67–76}}</ref><ref name="suresh">{{cite book|last = Suresh|first = Bala|year = 2003|url = http://www.sriconsulting.com/CEH/Public/Reports/602.5000/|chapter = Acetic Acid|title = Chemicals Economic Handbook|pages = 602.5000|publisher = SRI International}}</ref> शुद्ध एसिटिक अम्ल के दो सबसे बड़े निर्माता [[सीलेनीज]] और [[BP केमिकल्स]] हैं. दूसरे बड़े निर्माताओं में [[मिलेनियम केमिकल्स]], [[स्टर्लिंग केमिकल्स]], [[सैमसंग]], [[ईस्टमैन]] और [[वैंन्सक इटेनोल्केमी]] शामिल हैं. |
|||
===मिथेनॉल कार्बोनाइलिकरण=== |
|||
ज्यादातर शुद्ध एसिटिक अम्ल मिथेनॉल कार्बोनाइलिकरण से बनाया जाता है. इस प्रक्रिया में रसायनिक समीकरण के अनुसार [[मिथेनॉल]] और [[कार्बन मोनोऑक्साइड]] क्रिया कर एसिटिक अम्ल बनाते हैं. |
|||
: CH <sub>3</sub> OH + CO → CH <sub>3</sub>COOH |
|||
ये प्रक्रिया तीन पदों में संपन्न होती है और इसमें एक मध्यवर्ती के रूप में [[आयोडोमीथेन]] बनता है. कार्बोनाइलिकरण की क्रिया में [[उत्प्रेरक]] के लिए आमतौर पर एक [[जटिल]] धातु की जरूरत पड़ती है (स्टेप 2). |
|||
#CH <sub>3</sub> OH + HI → CH <sub>3</sub>I + H<sub>2</sub>O |
|||
#CH<sub>3</sub>I + CO → CH<sub>3</sub>COI |
|||
#CH<sub>3</sub>COI + H<sub>2</sub>O → CH<sub>3</sub>COOH + HI |
|||
प्रक्रिया की परिस्थितियों में फेर बदल करके एक ही संयंत्र में [[एसिटिक एन्हाइड्राइड]] भी बनाया जा सकता है. क्योंकि मिथेनॉल और कार्बन मोनोऑक्साइड दोनों ही कच्चा माल हैं, एसिटिक अम्ल के उत्पादन के लिए मिथेनॉल कार्बोनाइलीकरण लंबे समय से एक आकर्षक विधि रही है. [[ब्रिटिश सिलेनीज]] के हेनरी ड्रेफियस ने सन् 1925 में मिथेनॉल कार्बोनाइलिकरण का प्रायोगिक संयंत्र विकसित किया था. <ref name="wagner">{{cite book|last = Wagner|first = Frank S.|year = 1978|chapter = Acetic acid|editor-last = Grayson|editor-first = Martin|title = Kirk-Othmer Encyclopedia of Chemical Technology|edition = 3rd|location = New York|publisher = [[John Wiley & Sons]]}}</ref> हालांकि व्यावहारिक सामग्री की कमी जो कि संक्षारक प्रतिक्रिया मिश्रण को आवश्यक उच्च [[दाब]] (200 [[atm]] या ज्यादा ) पर रख सके की कमी ने इसके व्यावसायिकरण को हतोत्साहित किया. सर्वप्रथम 1963 में जर्मन रसायन कंपनी [[BASF]] के द्वारा वाणिज्यिक मिथेनॉल कार्बोनाइलिकरण प्रक्रिया विकसित की गई जिसमें [[कोबाल्ट]] उत्प्रेरक का उपयोग किया गया. 1968 में एक [[रोडियम]] आधारित उत्प्रेरक (''cis'' −[Rh(CO)<sub>2</sub>I<sub>2</sub>]<sup>−</sup>) का ईजाद किया गया जो प्रक्रिया को बिना किसी सहउत्पाद के कम दबाव पर कुशलतापूर्वक संचालित कर सकता था. इस उत्प्रेरक का उपयोग करते हुए सन् 1970 में US रसायन [[मोन्सेंटो कंपनी]] ने पहला संयंत्र स्थापित किया और रोडियम उत्प्रेरित मिथेनॉल कार्बोनाइलिकरण एसिटिक अम्ल के उत्पादन का सबसे प्रमुख तरीका बन गया([[मोन्सेंटो प्रक्रिया]] देखें). 1990 के दशक के अंत में रसायन कंपनी [[BP कैमिकल्स]] ने [[रूथेनियम]] के द्वारा उन्नत [[केटिवा]] उत्प्रेरक ([Ir(CO)<sub>2</sub>I<sub>2</sub>]<sup>−</sup>) का वाणिज्यिकरण किया. ये [[इरिडियम]]-उत्प्रेरित [[केटिवा प्रक्रिया]] ज्यादा [[हरित]] और कुशल है <ref name="lancaster">{{cite book|last = Lancaster|first = Mike|year = 2002|title = Green Chemistry, an Introductory Text|location = Cambridge|publisher = Royal Society of Chemistry|pages=262–66|isbn = 0-85404-620-8}}</ref> और इसने बड़े पैमाने पर अक्सर उन्ही संयंत्रों में मोन्सेंटो प्रक्रिया को प्रतिस्थापित कर दिया. |
|||
===एसीटैल्डिहाइड ऑक्सीकरण=== |
|||
मोन्सेंटो प्रक्रिया के व्यावसायीकरण से पहले ज्यादातर एसिटिक अम्ल [[एसिटैल्डिहाइड]] के ऑक्सीकरण से बनाया जाता था. ये दूसरी सबसे महत्वपूर्ण निर्माण पद्धति रही है हालांकि ये मिथेनॉल कार्बोनाइलेशन के साथ प्रतिस्पर्धा नहीं कर सकती. |
|||
एसीटैल्डिहाइड को ब्यूटेन या हल्के नेफ्था के [[ऑक्सीकरण]] या इथाइलीन के हाइड्रेशन से बनाया जा सकता है. [[रासायनिक समीकरण]] के अनुसार जब [[ब्यूटेन]] या हल्का [[नेफ्था]] को हवा के साथ विभिन्न धातु [[आयनों]] जिनमें [[मैंगनीज]], [[कोबाल्ट]] और [[क्रोमियम]] शामिल हैं की उपस्थिति में गर्म किया जाता है तो [[प्रिऑक्साइड]] बनते हैं और उनके विघटन से एसिटिक अम्ल बनता है. |
|||
: 2 C<sub>4</sub>H<sub>10</sub> + 5 O<sub>2</sub> → 4 CH<sub>3</sub>COOH + 2 H<sub>2</sub>O |
|||
आमतौर पर यह अभिक्रिया ब्यूटेन को तरल बनाए रखते हुए [[ताप]] और दाब के संयोजन को अधिक से अधिक गर्म रखते हुए संचालित की जाती है. विशिष्ट अभिक्रिया परिस्थितियां 150 डिग्री सेल्सियस और 55 atm हैं. [[ब्यूटेनोन]], [[एथाइल एसीटेट]], [[फोर्मिक अम्ल]] और [[प्रोपिओनिक अम्ल]] समेत सह उत्पाद भी बन सकते है. ये सह उत्पाद भी वाणिज्यिक रूप से मूल्यवान हैं और अगर ये आर्थिक रूप से उपयोगी हैं तो इनका ज्यादा मात्रा में उत्पादन करने के लिए अभिक्रिया परिस्थितियों को परिवर्तित किया जा सकता है. हालांकि इन सह उत्पादों से एसिटिक अम्ल को अलग करने की प्रक्रिया, लागत को बढ़ा देती है. |
|||
ब्यूटेन के ऑक्सीकरण के लिए उपयोगी परिस्थितियों और [[उत्प्रेरकों]] को इस्तेमाल कर [[हवा]] की [[ऑक्सीजन]] से [[एसीटेल्डिहाइड]] का ऑक्सीकरण कर एसिटिक अम्ल बनाया जा सकता है. |
|||
: 2 CH<sub>3</sub>CHO + O<sub>2</sub> → 2 CH<sub>3</sub>COOH |
|||
आधुनिक उत्प्ररकों के इस्तेमाल से इसी अभिक्रिया द्वारा एसिटिक अम्ल की उपज बढ़ाई जा सकती है. इसमें बनने वाले प्रमुख सह उत्पादों [[इथाइल एसीटेट]], [[फोर्मिक अम्ल]] और [[फोर्मेल्डिहाइड]] के [[क्वथनांक]] एसिटिक अम्ल से कम होते हैं और इन्हे [[आसवन]] द्वारा आराम से अलग कर लिया जाता है. <ref name="NIST">{{cite web|url = http://webbook.nist.gov/cgi/cbook.cgi?ID=C64197&Units=SI&Mask=4#Thermo-Phase|accessdate = 2008-02-03|publisher = National Institute of Standards and Technology|title = Acetic acid}}</ref> |
|||
===इथाइलीन ऑक्सीकरण=== |
|||
[[एथिलीन]] से एसीटैल्डिहाइड [[वेकर प्रक्रिया]] से भी बनाया जा सकता है और फिर ऊपर दर्शाई विधि अनुसार ऑक्सीकृत किया जा सकता है. हाल ही में रसायन कंपनी [[शोवा डेंको]] जिसने 1997 में [[जापान]] के [[ओइटा]] में एक एथाइलीन ऑक्सीकरण संयंत्र खोला था ने इथाइलीन से एसिटिक अम्ल रूपांतरण की एक सस्ती एकल चरण प्रक्रिया का व्यावसायिकरण किया. <ref name="sano">{{cite book|last = Sano|first = Ken-ichi|coauthors = Uchida, Hiroshi; Wakabayashi, Syoichirou|year = 1999|title = A new process for acetic acid production by direct oxidation of ethylene| |
|||
journal = [[Catalyst Surveys from Japan]]|volume = 3|pages = 66–60|doi = 10.1023/A:1019003230537}}</ref> ये प्रक्रिया एक [[पैलेडियम]] धातु उत्प्रेरक की सहायता से एक [[हिटरोपॉली अम्ल]] जैसे कि [[टंगैस्टोसिलिसिक अम्ल]] पर की गई. इथाइलीन कि स्थानीय कीमतों पर निर्भर करते हुए इसे छोटे संयंत्रों(100-250 किलो टन प्रतिवर्ष) के लिए मिथेनॉल कार्बोनाइलीकरण का प्रतिस्पर्धी माना गया. |
|||
===ऑक्सीडेटिव किण्वन=== |
|||
मानव इतिहास का ज्यादातर एसिटिक अम्ल जीनस ''[[एसीटोबैक्टर]]'' जीवाणुओं द्वारा सिरका के रूप में बनाया गया. पर्याप्त ऑक्सीजन दिये जाने पर ये जीवाणु विभिन्न एल्कोहॉली भोज्य पदार्थों से सिरका का निर्माण कर सकते हैं. सामान्यतया उपयोग में लिए जाने वाले चारे में [[सेब का आसव]], [[शराब]] और किण्वित [[अनाज]], [[जौ]], [[चावल]] या [[आलू]] का गूदा शामिल हैं. इन जीवाणुओं द्वार संपंन्न की जाने वाली रसायनिक अभिक्रिया कुल मिलाकर इस तरह है: |
|||
: C<sub>2</sub>H<sub>5</sub>OH + O<sub>2</sub> → CH<sub>3</sub>COOH + H<sub>2</sub>O |
|||
शराब के एक तरल विलयन में ''एसीटोबैक्टर'' जीवाणु डाल कर उसे एक गर्म, हवादार स्थान पर रखने से कुछ महीनों में सिरका तैयार होता है. औद्योगिक सिरका निर्माण विधि में इस प्रक्रिया को जीवाणु के लिए [[ऑक्सीजन]] आपूर्ति को बढ़ा कर तेज कर दिया जाता है. |
|||
शायद [[शराब निर्माण]] प्रक्रिया में हुई किसी गलती के कारण किण्वण द्वारा प्रथम बार सिरका बना. अगर बहुत ज्यादा तापमान पर किण्वन हो रहा है तो [[अंगूरों]] पर स्वाभाविक तौर पर आया [[खमीर]] एसीटोबैक्टर से [[जरूर]] भर जायेगा. जैसे जैसे खाद्य, चिकित्सा औऱ स्वच्छता के लिए सिरका की मांग बढ़ी अंगूर की शराब के व्यापारियों ने अंगूरों के परिपक्व होने और शराब निर्मित करने लायक होने से पहले गर्मी के महीनों में दूसरे कार्बनिक पदार्थों से सिरका बनाना सीख लिया. हालांकि ये पद्धति धीमी थी और हमेशा सफल नहीं होती थी क्योंकि शराब के व्यापारी प्रक्रिया को समझ नहीं पाये थे. <ref name="Hromatka">{{cite journal|title = Vinegar by Submerged Oxidative Fermentation| author = Otto Hromatka and Heinrich Ebner|journal = Ind. Eng. Chem.|year = 1959|volume = 51|issue = 10|pages = 1279–1280| doi = 10.1021/ie50598a033}}</ref> |
|||
जर्मनी में 1823 से पहले काम में ली गयी "तीव्र विधि" या "जर्मन विधि" सबसे पहली आधुनिक वाणिज्यिक प्रक्रियाओं में से एक थी. इस प्रक्रिया में लकड़ी की कतरन या [[कोयले]] से बंद एक गुंबज में किण्वन की क्रिया होती है. शराब से भरी फीड गुंबज के शीर्ष से धीरे धीरे अंदर गिराई जाती है और ताजा [[हवा]] की आपूर्ती नीचे से या तो प्राकृतिक या कृत्रिम [[संवहन]] द्वारा की जाती है. हवा की आपूर्ति में सुधार से सिरका निर्माण की ये प्रक्रिया महीनों की बजाय हफ्तों में संपन्न हो जाती है. <ref>{{cite journal|title = Acetic Acid and Cellulose Acetate in the United States A General Survey of Economic and Technical Developments|author = Everett P. Partridge|journal = Ind. Eng. Chem.|year = 1931|volume = 23|issue =5|pages = 482 –498|doi = 10.1021/ie50257a005}}</ref> |
|||
आजकल ज्यादातर सिरका जलमग्न टैंक [[संस्कृति]] में बनाया जाता है जिसका वर्णन 1949 में औट्टो ह्रोमोट्का और हैनरिच एब्नर ने किया. <ref>{{cite journal|title = Investigations on vinegar fermentation: Generator for vinegar fermentation and aeration procedures|author = O Hromatka, H Ebner|journal = Enzymologia|volume=13|page=369|year = 1949}}</ref> इस विधि में लगातार विलोड़ित की जाती हुई टंकी के विलयन में हवा के बुलबुलों द्वारा ऑक्सीजन की आपूर्ती करते हुए शराब को किण्वित कर सिरका में बदला जाता है. इस विधि के आधुनिक अनुप्रयोगों को इस्तेमाल करते हुए बैच प्रक्रिया द्वारा 15 प्रतिशत एसिटिक अम्ल का सिरका केवल 24 घंटों में तैयार किया जा सकता है यहां तक 20 प्रतिशत केवल 60 घंटों में फैड – बैच प्रक्रिया से बनाया जा सकता है. <ref name="Hromatka"></ref> |
|||
===वात निरपेक्ष किण्वन=== |
|||
जीनस ''[[क्लोस्ट्रीडियम]]'' समेत वात [[निरपेक्ष जीवाणुओं]] की प्रजातियां ईथेनॉल की मध्यस्थता के बगैर ही शक्कर को सीधे एसिटिक अम्ल में बदल सकती हैं. इन जीवाणुओं द्वारा की जाने वाली पूरी रासायनिक क्रिया को निम्न प्रकार दर्शाया जा सकता है: |
|||
: C<sub>6</sub>H<sub>12</sub>O<sub>6</sub> → 3 CH<sub>3</sub>COOH |
|||
औद्योगिक रसायनज्ञों के दृष्टिकोण से ये [[एसीटोजेनिक जीवाणु]] और ज्यादा दिलचस्प हैं क्योंकि ये [[मेथेनॉल]], [[कार्बन मोनोऑक्साइड]] या [[कार्बन डाइऑक्साइड]] और [[हाइड्रोजन]] के एक मिश्रण समेत एक-कार्बन यौगिकों से एसिटिक अम्ल निर्मित कर सकते हैं: |
|||
: 2 CO<sub>2</sub> + 4 H<sub>2</sub> → CH<sub>3</sub>COOH + 2 H<sub>2</sub>O |
|||
''क्लोस्ट्रीडियम'' की सीधे शक्कर या सस्ते आदानों के इस्तेमाल से एसिटिक अम्ल बनाने की क्षमता ये बताती है कि ये जीवाणु ईथेन ऑक्सीकारकों जैसे ''एसीटोबैक्टर'' से ज्यादा कुशलता से एसिटिक अम्ल बना सकते हैं. हालांकि ''क्लोस्ट्रीडियम'' जीवाणु ''एसीटोबैक्टर'' की तुलना में कम अम्ल सहिष्णु हैं. यहां तक की सबसे ज्यादा अम्ल सहिष्णु ''क्लोस्ट्रीडियम'' उपभेद केवल कुछ प्रतिशत एसिटिक अम्ल वाला सिरका बना सकता है जबकि ''एसिटोबैक्टर'' उपभेद 20 प्रतिशत तक एसिटिक अम्ल वाला सिरका बना सकता है. वर्तमान में ''एसीटोबैक्टस'' के इस्तेमाल से सिरका बनाना ''क्लोस्ट्रीडियम'' के इस्तेमाल से सिरका बना कर उसे सांद्र करने से ज्यादा सस्ता है. परिणामस्वरूप हालांकि एसिटोजेनिक जीवाणु 1940 से ज्ञात होने के बावजूद उनका औद्योगिक इस्तेमाल कुछ आला अनुप्रयोगों तक ही सीमित रहा है. <ref>{{cite journal|journal = Enzyme and Microbial Technology|volume = 40|issue = 5|year = 2007|pages = 1234–1243| |
|||
doi = 10.1016/j.enzmictec.2006.09.017|title = Clostridium aceticum—A potential organism in catalyzing carbon monoxide to acetic acid: Application of response surface methodology|author = Jia Huey Sim, Azlina Harun Kamaruddin, Wei Sing Long and Ghasem Najafpour}}</ref> |
|||
==अनुप्रयोग== |
|||
[[File:Acetic acid winchester.JPG|thumb|एक प्रयोगशाला में 2.5 लीटर की एसिटिक एसिड बोतल. एम्बर कांच से बनी बोतल.]] |
|||
एसिटिक अम्ल रासायनिक [[यौगिकों]] के निर्माण के लिए एक रासायनिक अभिकर्मक है. एसिटिक एनहाइड्राइड और एस्टर के अलावा अकेले विनाइल एसिटेट [[एकलक]] के निर्माण में ही एसिटिक अम्ल का सबसे बड़ा उपयोग होता है. सिरका में एसिटिक अम्ल का उपयोग तुलनात्मक रूप से कम है. <ref name="suresh"></ref> |
|||
===विनाइल एसीटेट एकलक=== |
|||
[[विनाइल एसीटेट एकलक (VAM)]] के निर्माण में एसिटिक अम्ल का प्रमुख उपयोग होता है. ये अनुप्रयोग एसिटिक अम्ल के वैश्विक उत्पादन का 40 से 45 प्रतिशत उपयोग में ले लेता है. [[पैलेडियम]] [[उत्प्रेरक]] की उपस्थिति में [[इथाइलीन]] और एसिटिक अम्ल की [[ऑक्सीजन]] से अभिक्रिया होती है. |
|||
: 2 H<sub>3</sub>C-COOH + 2 C<sub>2</sub>H<sub>4</sub> + O<sub>2</sub> → 2 H<sub>3</sub>C-CO-O-CH=CH<sub>2</sub> + 2 H<sub>2</sub>O |
|||
विनाइल एसीटेट [[पॉलीविनाइल एसीटेट]] या दूसरे [[बहुलकों]] में बहुलित हो सकता है जो कि [[रंग]] और [[गोंद]] बनाने के काम में आते हैं. |
|||
===एस्टर उत्पादन=== |
|||
एसिटिक अम्ल के प्रमुख [[एस्टर]] सामान्यत: [[स्याही]], [[रंगों]] और [[परतों]] के विलायक बनाने के काम आते हैं. [[इथाइल एसीटेट]], n-[[ब्यूटाइल एसीटेट]], [[आइसोब्यूटाइल एसीटेट]] और [[प्रोपाइल एसीटेट]] एस्टर में इसमें शामिल हैं. ये आम तौर पर एसिटिक अम्ल और संबंधित [[अल्कोहल]] की [[उत्प्रेरित]] अभिक्रियाओं द्वारा उत्पादित किये जाते हैं: |
|||
: H<sub>3</sub>C-COOH + HO-R → H<sub>3</sub>C-CO-O-R + H<sub>2</sub>O, (R = एक सामान्य [[एल्काइल समूह]]) |
|||
हालांकि ज्यादातर एसीटेट एस्टर [[एसीटलडिहाइड]] का इस्तेमाल करते हुए [[टाइशेंको अभिक्रिया]] द्वारा उत्पादित किये जाते हैं. इसके अतिरिक्त ईथर एसीटेट का उपयोग [[निट्रोसेल्यूलोज]], [[एक्रेलिक रोगन]], [[वार्निश]] और लकड़ी के दागों के विलायक के रूप में किया जाता है. पहले [[ईथाइलीन ऑक्साइड]] या [[प्रोपाइलीन ऑक्साइड]] के साथ एल्कोहॉल की क्रिया से ग्लाइकॉल मोनोईथर बनाया जाता है जिसे फिर एसिटिक अम्ल के साथ एस्टरीकृत किया जाता है. तीन प्रमुख उत्पाद हैं, इथाइलीन ग्लाइकॉल मोनोइथाइलीन ईथर एसीटेट (EEA), इथाइलीन ग्लाइकॉल मोनोब्यूटाइलीन ईथर एसीटेट (EBA) और प्रोपाइलीन ग्लाइकॉल मोनोमिथाइल ईथर एसीटेट (PMA). ये अनुप्रयोग एसिटिक अम्ल के वैश्विक उत्पादन का 15 से 20 प्रतिशत उपभोग में ले लेता है. ईथर एसीटेट, उदाहरण के लिए EEA मानव प्रजनन के लिए हानिकारक बताया गया है. <ref name="suresh"></ref> |
|||
===एसिटिक एनहाइड्राइड=== |
|||
[[एसिटिक एनहाइड्राइड]], एसिटिक अम्ल के दो अणुओं का [[संघनित]] उत्पाद है. एसिटिक एनहाड्राइड का वैश्विक उत्पादन एक प्रमुख अनुप्रयोग है और ये एसिटिक अम्ल के वैश्विक उत्पादन का करीब 25 से 30 प्रतिशत काम में लेता है. एसिटिक एनहाइड्राइड अम्ल के बिना ही [[मिथेनॉल कार्बोनिलिकर]]ण के द्वारा सीधा बनाया जा सकता है और एनहाइड्राइड उत्पादन के लिए [[कैटिवा]] उत्पादन संयंत्र का उपयोग किया जा सकता है. |
|||
[[File:Acetic acid condensation.svg|412px|एसिटिक एसिड से एसिटिक एनहाइड्राइड का संघनन]] |
|||
एसिटिक एनहाइड्राइड एक मजबूत [[एसिटिलिकरण]] घटक है. जैसे इसका मुख्य उपयोग [[सैल्यूलोज एसिटेट]] जो कि एक कृत्रिम [[कपड़ा]] है जो [[फोटोग्राफी फिल्म]] बनाने के काम भी लिया जाता है के लिए है. एसिटिक एनहाइड्रिडाइड [[एस्प्रिन]], [[हैरोइन]] और दूसरे यौगिक बनाने का एक अभिकर्मक भी है. |
|||
===सिरका=== |
|||
[[सिरका]] के रूप में एसिटिक अम्ल विलयन (आमतौर पर 4 से 18 प्रतिशत एसिटिक अम्ल, प्रतिशत बड़े पैमाने पर परिकलित किया जाता है) सीधे तौर पर एक [[मसाले]] के रूप में और सब्जियों एवं दूसरे खाद्य पदार्थों के [[अचारीकरण]] में प्रयुक्त होता है. मेज पर प्रयुक्त होने वाला सिरका साधारणत: पतला(4 से 8 प्रतिशत एसिटिक अम्ल) होता है, जबकि वाणिज्यिक खाद्य अचारीकरण के लिए प्रयुक्त किया जाने वाला विलयन ज्यादा सघन होता है. सिरका के रूप में प्रयुक्त होने वाले एसिटिक अम्ल की मात्रा वैश्विक पैमाने पर बहुत ज्यादा नहीं है, लेकिन ऐतिहासिक दृष्टि से ये अब तक का सबसे पुराना और सबसे ज्ञात अनुप्रयोग है. |
|||
===विलायक के रूप में प्रयोग=== |
|||
ग्लैशियल एसिटिक अम्ल जैसा कि [[ऊपर]] उल्लेख किया गया है एक उत्कृष्ट ध्रुवीय [[प्रोटिक विलायक]] है. ये कार्बनिक यौगिकों का [[पुनःर्क्रिस्टलीकरण]] कर उन्हे शुद्ध करने के लिए एक विलायक के रूप में सतत रूप से प्रयोग में लिया जाता रहा है. [[टैरेफ्थेलिक अम्ल]] (TPA) जो कि [[पॉलिइथाइलीन टेरफ्थेलेट]] (PET) के लिए कच्चा माल है के उत्पादन में शुद्ध एसिटिक अम्ल एक [[विलायक]] की तरह काम में लिया जाता है. हालांकि वर्तमान {{When|date=December 2009}} में इस विशेष अनुप्रयोग के लिए दुनिया भर में 5से 10 प्रतिशत एसिटिक अम्ल का उपयोग हो रहा है जो अगले दशक में PET के उत्पादन में बढ़ौतरी के साथ धीरे-धीरे बढ़ने का अनुमान है. <ref name="suresh"></ref> |
|||
एसिटिक अम्ल अक्सर ऐसी अभिक्रियाओं जिनमें [[कार्बोकेशन]] होता है, जैसे कि [[फ्रिडेल-क्राफ्ट एल्केलिकरण]] के लिए विलायक के तौर पर उपयोग में लिया जाता है. उदाहरण के लिए कृत्रिम कपूर के वाणिज्यिक उत्पादन के एक चरण में [[कैंफीन]] के आइसोबोर्निल एसीटेट में [[वैग्नर – मीरवैन पुनर्व्यवस्थन]], यहां एसिटिक अम्ल [[पुनर्व्यवस्थित]] कार्बोकरण के लिए एक [[जाल]] और एक विलायक दोनों की तरह काम करता है. [[कार्बन पर पैलेडियम]] के उपयोग से एक [[एरिल]] [[नाइट्रो]] – समूह के [[एनिलिन]] में [[विघटित]] होने कि क्रिया में एसिटिक अम्ल एक पसंदीदा विलायक होता है. |
|||
ग्लैशियल एसिटिक अम्ल कमजोर एल्केलाइन पदार्थों जैसे कि कार्बनिक मध्यस्थों के आकलन के लिए विश्लेषणात्मक रसायन विज्ञान में काम में लिया जाता है. ग्लैशियल एसिटिक अम्ल जल से ज्यादा कमजोर [[क्षार]] है इसीलिए मध्यस्थ इस माध्यम में एक मजबूत क्षार की तरह व्यवहार करते हैं. ये तब एक बहुत तेज अम्ल जैसे कि [[परक्लोरिक अम्ल]] के ग्लैशियल एसिटिक अम्ल में विलयन बनाकर अनुमापित किया जा सकता है. |
|||
===अन्य अनुप्रयोग=== |
|||
एसिटिक अम्ल की हलकी [[अम्लता]] के कारण इसके तनु विलयनों का प्रयोग किया जाता है. उदाहरण के लिए [[घरों]] में फोटोग्राफिक फिल्म के विकास के दौरान एक [[स्टॉप बाथ]] के रूप में और कंदीलों और केतलियों के [[लाइमस्केल]] को हटाने के लिए [[डीस्केलिंग घटक]] के रूप में. |
|||
ग्लैशियल एसिटिक अम्ल का तनु विलयन [[चिकित्सकीय प्रयोगशालाओं]] में [[सफेद रक्त कोशिकाओं]] को गिनने के लिए [[लाल रक्त कोशिकाओं]] को घोलने में किया जा सकता है. इसका दूसरा नैदानिक प्रयोग उन लाल रक्त कोशिकाओं को घोलने के लिए है जो सूक्ष्म परीक्षण के दौरान मूत्र के दूसरे महत्वपूर्ण घटकों को अस्पष्ट कर सकती है. |
|||
अम्लता का उपयोग [[बॉक्स जैलिफिश]] के डंक के उपचार के लिए किया जाता है जिसमें जैलिफिश के चुभने वाली कोशिकाओं को अक्षम कर दिया जाता है, अगर तुरंत लगाया जाये तो गंभीर चोट या मृत्यु से बचा जा सकता है और लोगों में [[कानों के बाहरी संक्रमण]] के उपचार के लिए [[वोसोल]] जैसी दवाइयां बनाने में. इसी तरह एसिटिक अम्ल पशुओं के लिए [[परिरक्षित]] चारे को [[संरक्षित]] रखने के लिए उस पर छिड़कने के काम आता है ताकि उसमें जीवाणुओं और [[कवकों]] का विकास ना हो. ग्लैशियल एसिटिक अम्ल [[दाग]] औऱ [[मस्सा]] हटाने के काम भी आता है. |
|||
एसिटिक अम्ल से निम्न सहित कार्बनिक या अकार्बनिक लवणों का निर्माण किया जाता है: |
|||
*[[सोडियम एसीटेट]] - [[कपड़ा]] उद्योग में और खाद्य [[संरक्षक]] ([[E262]]) के रूप में उपयोग किया जाता है. |
|||
*[[कॉपर(II) एसिटेट]] - एक [[रंजक]] और एक [[कवकनाशी]] के रूप में उपयोग किया जाता है. |
|||
*[[एल्यूमीनियम एसीटेट]] और [[आयरन(II) एसीटेट]] – [[रंजकों]] को और [[तीव्र]] बनाने के रूप में उपयोग किया जाता है. |
|||
*[[पैलेडियम(II) एसीटेट]] – कार्बनिक युग्मी क्रियाओं जैसे [[हैक अभिक्रिया]] के लिए उत्प्रेरक के रूप में उपयोग किया जाता है. |
|||
*[[सिल्वर एसीटेट]] - एक [[कीटनाशी]] के रूप में उपयोग किया जाता है. |
|||
वैकल्पिक एसिटिक अम्लों का उत्पादन में शामिल हैं: |
|||
*[[मोनोक्लोरोएसिटिक अम्ल]](MCA), डाइक्लोरोएसिटिक अम्ल(एक सहउत्पाद माना जाता है) और [[ट्राईक्लोरोएसिटिक अम्ल]]. MCA [[इंडिगो रंजक]] के उत्पादन में प्रयुक्त किया जाता है. |
|||
*[[ब्रोमोएसिटिक अम्ल]] जिसका एस्टरीकृत करके [[इथाइल ब्रोमोएसिटेट]] अभिकर्मक बनाया जाता है. |
|||
*[[ट्राईफ्लोरोएसिटिक अम्ल]], जो कि [[कार्बनिक संश्लषण]] में एक आम अभिकर्मक है. |
|||
वैश्विक स्तर पर इन सभी अनुप्रयोगों में एक साथ इस्तेमाल किये गये एसिटिक अम्ल (TPA को छोड़ कर) की मात्रा 5 से 10 प्रतिशत होती है. हालांकि एसी उम्मीद नहीं की जाती कि ये अनुप्रयोग TPA के उत्पादन जितना बढ़ेंगे. <ref name="suresh"></ref> पतला एसिटिक अम्ल आयन्टोफोरेसिस के माध्यम से दागी ऊतक के पिंडों को तोड़कर शारिरिक चिकित्सा के काम आते हैं. |
|||
==सुरक्षा== |
|||
सांद्र एसिटिक अम्ल एक [[संक्षारक]] है और इसलिए उचित सावधानी के साथ संभाला जाना चाहिए, क्योंकि ये त्वचा जला सकता है, स्थायी रूप से आंख को नुकसान पहुंचा सकता है और श्लेष्मा झिल्ली में जलन कर सकता है. ये जलन और फफोले संपर्क में आने के कई घंटों बाद दिख सकते हैं. [[लेटेक्स]] के दस्ताने इससे बचाव नहीं कर सकते इसलिए इस यौगिक का उपयोग करते समय विशेष प्रतिरोधी दस्ताने जैसे [[निट्राइल रबर]] से बने दस्ताने पहने जाते हैं. सांद्र अम्ल कठिनाई के साथ प्रयोगशाला में प्रज्वलित किया जा सकता है. अगर परिवेश का तापमान 39 °C (102 °F) से बढ़ जाये तो ये एक ज्वलनशील खतरा बन जाता है और इस तापमान से ऊपर हवा के साथ मिल कर एक विस्फोटक मिश्रण बना सकता है( [[विस्फोटक सीमायें]]: 5.4–16%) |
|||
एसिटिक अम्ल के विलयनों के खतरे सांद्रता पर निर्भर करते हैं. निम्नलिखित तालिका में एसिटिक अम्ल के विलयनों के [[EU वर्गीकरण]] की सूची दी गई है: |
|||
[[File:Hazard C.svg|thumb|सुरक्षा प्रतीक]] |
|||
{| class="wikitable" |
|||
|- |
|||
! [[सांद्रता]]<br>भार के अनुसार |
|||
! मोलरता |
|||
! वर्गीकरण |
|||
! [[R-शब्द]] |
|||
|- |
|||
| 10–25% |
|||
| 1.67–4.16 mol/L |
|||
| प्रकोपक '''(xi)''' |
|||
| {{R36/38}} |
|||
|- |
|||
| 25-90% |
|||
| 4.16–14.99 mol/L |
|||
| नाशक '''(C)''' |
|||
| {{R34}} |
|||
|- |
|||
| >90% |
|||
| >14.99 mol/L |
|||
| नाशक '''(C)''' ज्वलनशील '''(F)''' |
|||
| {{R10}} , {{R35}} |
|||
|- |
|||
|} |
|||
25 प्रतिशत से अधिक सांद्रता वाला एसिटिक अम्ल तीखी और संक्षारक वाष्प की वजह से ढ़क्कन वाले पात्र में रखा जाता है. सिरका के रूप में तनु एसिटिक अम्ल हानिरहित होता है. हालांकि तीव्र विलयन का सेवन मनुष्यों और पशुओं के लिए खतरनाक होता है. ये [[पाचन तंत्र]] को गंभीर नुकसान पहुंचा सकता है और [[रक्त]] की अम्लता में गंभीर जानलेवा परिवर्तन कर सकता है. |
|||
असंगति के कारण एसिटिक अम्ल को [[क्रोमिक अम्ल]], [[इथाइलीन ग्लाइकॉल]], [[नाइट्रिक अम्ल]], [[परक्लोरिक अम्ल]], [[परमैंगनेटों]], [[परऑक्साइडों]] औऱ [[हाइड्रॉक्सिलों]] से दूर रखने की सलाह दी जाती है. |
|||
==इन्हें भी देखें== |
|||
*[[एसीटल समूह]], CH <sub>3-CO</sub> - समूह, ''Ac'' संक्षिप्त |
|||
*[[शराब में एसिड ]] |
|||
*[[आम रसायन]], जहां आम रसायनों खरीद प्रयोगों में इस्तेमाल करने के लिए किया जाता है |
|||
*[[सोडियम साइट्रेट]] |
|||
==संदर्भ== |
|||
{{reflist|2}} |
|||
==बाह्य लिंक== |
|||
{{commons}} |
|||
*{{ICSC|0363|03}} |
|||
*[http://www.npi.gov.au/database/substance-info/profiles/2.html National Pollutant Inventory - Acetic acid fact sheet] |
|||
*[http://www.cdc.gov/niosh/npg/npgd0002.html NIOSH Pocket Guide to Chemical Hazards] |
|||
*[http://www.cdc.gov/niosh/nmam/pdfs/1603.pdf Method for sampling and analysis] |
|||
*[http://www.osha.gov/pls/oshaweb/owadisp.show_document?p_table=STANDARDS&p_id=9992 29 CFR 1910.1000, Table Z-1] (US अनुमत जोखिम सीमा) |
|||
*[http://chemsub.online.fr/cas_number/64-19-7.html ChemSub Online: CAS Number 64-19-7, Acetic acid] |
|||
*[http://www.orgsyn.org/orgsyn/chemname.asp?nameID=32786 Organic Syntheses] में एसिटिक एसिड का उपयोग |
|||
*एसिटिक एसिड और pH अनुमापन [http://www2.iq.usp.br/docente/gutz/Curtipot_.html - freeware for data analysis, simulation and distribution diagram generation] |
|||
*एसिटिक एसिड की [http://ddbonline.ddbst.de/AntoineCalculation/AntoineCalculationCGI.exe?component=Acetic+acid vapor pressure], [http://ddbonline.ddbst.de/DIPPR105DensityCalculation/DIPPR105CalculationCGI.exe?component=Acetic+acid liquid density], [http://ddbonline.ddbst.de/VogelCalculation/VogelCalculationCGI.exe?component=Acetic+acid dynamic liquid viscosity], [http://ddbonline.ddbst.de/DIPPR106SFTCalculation/DIPPR106SFTCalculationCGI.exe?component=Acetic+acid surface tension] की परिकल्पना |
|||
{{Otologicals}} |
|||
{{DEFAULTSORT:Acetic Acid}} |
|||
[[Category:एसीटेट]] |
|||
[[Category:सिगरेट योगात्मक]] |
|||
[[Category:स्वाद]] |
|||
[[Category:घरेलू रसायन]] |
|||
[[Category:ओनोलॉजी]] |
|||
[[Category:फोटोग्राफिक रसायन]] |
|||
[[Category:विलायक]] |
|||
[[Category:विश्व स्वास्थ्य संगठन आवश्यक दवाइयां]] |
|||
[[Category:एसिटिक एसिड ]] |
|||
{{Link FA|bg}} |
|||
{{Link FA|ro}} |
|||
{{Link FA|zh}} |
|||
{{Link FA|id}} |
|||
[[af:Asynsuur]] |
|||
[[ar:حمض الخليك]] |
|||
[[bn:অ্যাসিটিক এসিড]] |
|||
[[bg:Оцетна киселина]] |
|||
[[ca:Àcid acètic]] |
|||
[[cs:Kyselina octová]] |
|||
[[cy:Asid asetig]] |
|||
[[da:Eddikesyre]] |
|||
[[de:Essigsäure]] |
|||
[[en:Acetic acid]] |
|||
[[et:Etaanhape]] |
|||
[[el:Αιθανικό οξύ]] |
|||
[[es:Ácido acético]] |
|||
[[eo:Aceta acido]] |
|||
[[fa:اسید استیک]] |
|||
[[fr:Acide acétique]] |
|||
[[ga:Aigéad aicéiteach]] |
|||
[[gl:Ácido acético]] |
|||
[[ko:아세트산]] |
|||
[[io:Acetat-acido]] |
|||
[[id:Asam asetat]] |
|||
[[ia:Acido acetic]] |
|||
[[it:Acido acetico]] |
|||
[[he:חומצה אצטית]] |
|||
[[kn:ಅಸಿಟಿಕ್ ಆಮ್ಲ]] |
|||
[[la:Acidum aceticum]] |
|||
[[lv:Etiķskābe]] |
|||
[[lt:Acto rūgštis]] |
|||
[[hu:Ecetsav]] |
|||
[[mk:Оцетна киселина]] |
|||
[[ml:അസറ്റിക് അമ്ലം]] |
|||
[[ms:Asid asetik]] |
|||
[[nl:Azijnzuur]] |
|||
[[ja:酢酸]] |
|||
[[no:Eddiksyre]] |
|||
[[nn:Eddiksyre]] |
|||
[[pl:Kwas octowy]] |
|||
[[pt:Ácido etanoico]] |
|||
[[ro:Acid acetic]] |
|||
[[qu:Mama aqha p'uchqu]] |
|||
[[ru:Уксусная кислота]] |
|||
[[simple:Acetic acid]] |
|||
[[sk:Kyselina octová]] |
|||
[[sl:Projekt:Ocetna kislina]] |
|||
[[sr:Сирћетна киселина]] |
|||
[[su:Asam asétat]] |
|||
[[fi:Etikkahappo]] |
|||
[[sv:Ättiksyra]] |
|||
[[ta:அசிட்டிக் காடி]] |
|||
[[th:กรดน้ำส้ม]] |
|||
[[tr:Asetik asit]] |
|||
[[uk:Оцтова кислота]] |
|||
[[vi:Axít axetic]] |
|||
[[zh-yue:醋酸]] |
|||
[[zh:乙酸]] |
|||
09:07, 3 जून 2010 का अवतरण
| इस लेख में सत्यापन हेतु अतिरिक्त संदर्भ अथवा स्रोतों की आवश्यकता है। कृपया विश्वसनीय स्रोत जोड़कर इस लेख में सुधार करें। स्रोतहीन सामग्री को चुनौती दी जा सकती है और हटाया भी जा सकता है। (December 2009) स्रोत खोजें: "एसिटिक अम्ल" – समाचार · अखबार पुरालेख · किताबें · विद्वान · जेस्टोर (JSTOR) |
| एसिटिक अम्ल | |
|---|---|
 |
|
 |
 |
| आईयूपीएसी नाम | Ethanoic acid |
| प्रणालीगत नाम | Acetic acid |
| अन्य नाम | Acetyl hydroxide (AcOH), Hydrogen acetate (HAc), Ethylic acid, Methanecarboxylic acid |
| पहचान आइडेन्टिफायर्स | |
| सी.ए.एस संख्या | [64-19-7][CAS] |
| पबकैम | |
| SMILES | |
| InChI | |
| कैमस्पाइडर आई.डी | |
| गुण | |
| रासायनिक सूत्र | C2H4O2 |
| मोलर द्रव्यमान | 60.05 g mol−1 |
| दिखावट | colorless liquid |
| घनत्व | 1.049 g/cm3 (l) 1.266 g/cm3 (s) |
| गलनांक |
16.5 °C, 290 K, 62 °F |
| क्वथनांक |
118.1 °C, 391 K, 245 °F |
| जल में घुलनशीलता | Fully miscible |
| अम्लता (pKa) | 4.76 at 25 °C |
| श्यानता | 1.22 mPa·s at 25 °C |
| ढांचा | |
| Dipole moment | 1.74 D (gas) |
| खतरा | |
| EU वर्गीकरण | Corrosive (C) Flammable (F) |
| NFPA 704 | |
| R-फ्रेसेज़ | साँचा:R10, R35 |
| S-फ्रेसेज़ | (S1/2), साँचा:S23, S26, S45 |
| स्फुरांक (फ्लैश पॉइन्ट) | 43 °C |
| एलडी५० | 3310 mg/kg, oral (rat) |
| Related compounds | |
| संबंधित carboxylic acids | Formic acid Propionic acid |
| संबंधित रसायन/मिश्रण | Acetamide, Ethyl acetate, Acetyl chloride, Acetic anhydride, Acetonitrile, Acetaldehyde, Ethanol, Thioacetic acid, sodium acetate, potassium acetate |
| जहां दिया है वहां के अलावा, ये आंकड़े पदार्थ की मानक स्थिति (२५ °से, १०० कि.पा के अनुसार हैं। ज्ञानसन्दूक के संदर्भ | |
एसिटिक अम्ल CH3COOH जिसे एथेनोइक अम्ल के नाम से भी जाना जाता है, एक कार्बनिक अम्ल है जिसकी वजह से सिरका में खट्टा स्वाद और तीखी खुशबू आती है. यह इस मामले में एक कमज़ोर अम्ल है कि इसके जलीय विलयन में यह अम्ल केवल आंशिक रूप से विभाजित होता है. शुद्ध, जल रहित एसिटिक अम्ल (ठंडा एसिटिक अम्ल ) एक रंगहीन तरल होता है, जो वातावरण (हाइग्रोस्कोपी) से जल सोख लेता है और 16.5 °C (62 °F) पर जमकर एक रंगहीन क्रिस्टलीय ठोस में बदल जाता है. शुद्ध अम्ल और उसका सघन विलयन खतरनाक संक्षारक होते हैं.
एसिटिक अम्ल एक सरलतम कार्बोक्जिलिक अम्ल है. ये एक महत्वपूर्ण रासायनिक अभिकर्मक और औद्योगिक रसायन है, जिसे मुख्य रूप से शीतल पेय की बोतलों के लिए पोलिइथाइलीन टेरिफ्थेलेट; फोटोग्राफिक फिल्म के लिए सेलूलोज़ एसिटेट, लकड़ी के गोंद के लिए पोलिविनाइल एसिटेट और सिन्थेटिक फाइबर और कपड़े बनाने के काम में लिया जाता है. घरों में इसके तरल विलयन का उपयोग अक्सर एक डिस्केलिंग एजेंट के तौर पर किया जाता है. खाद्य उद्योग में एसिटिक अम्ल का उपयोग खाद्य संकलनी कोड E260 के तहत एक एसिडिटी नियामक और एक मसाले के तौर पर किया जाता है.
एसिटिक अम्ल की वैश्विक मांग क़रीब 6.5 मिलियन टन प्रतिवर्ष(Mt/a) है, जिसमें से क़रीब 1.5 Mt/a प्रतिवर्ष पुनर्प्रयोग या रिसाइक्लिंग द्वारा और शेष पेट्रोरसायन फीडस्टोक्स या जैविक स्रोतों से बनाया जाता है. स्वाभाविक किण्वन द्वारा उत्पादित जलमिश्रित एसिटिक अम्ल को सिरका कहा जाता है.
नामकरण
एसिटिक अम्ल का साधारण नाम लेटिन शब्द एसिटम से व्युत्पन्न है, जो सिरका के लिए प्रयोग किया जाता है और जो अम्ल शब्द से संबंध रखता है. इसका पर्यायवाची शब्द इथेनोइक अम्ल IUPAC के स्थानापन्न नामकरण के अनुसार किया गया है.
जल रहित एसिटिक अम्ल का एक छोटा नाम ग्लेशियल एसिटिक अम्ल है. घरेलु तापमान 16.7 डिग्री सेल्सियस(62 डिग्री फारेनहाईट) से जरा से कम तापमान पर बनने वाले बर्फ के जैसे क्रिस्टलों के जर्मन नाम ऐसेस्सिग (शाब्दिक रूप से हिम-सिरका) से भी ये नाम समानता रखता है.
एसिटिक अम्ल के लिए सबसे आम संक्षिप्त नाम HOAc है जहां Ac एसिटाइल वर्ग CH3−C(=O) को दर्शाता है. अम्ल आधारित क्रियाओं के संदर्भ में अक्सर संक्षिप्तिकरण HAc उपयोग में लिया जाता है जहां Ac एसिटेट ऋणायन(CH3COO−, संक्षिप्त रूप में AcO −), को इंगित करता है, हालांकि ये उपयोग अक्सर भ्रामक माना जाता है. दूसरे मामलों में रासायनिक तत्व एक्टिनियम के संक्षिप्तिकरण के साथ Ac को जोड़ के भ्रमित नहीं होना चाहिए. एसिटिक अम्ल का प्रयोगमिश्रित सूत्र C2H4O2 है. सोडियम एसिटेट लवण के निर्माण में सक्रिय हाइड्रोजन की भूमिका पर ज़ोर देने के लिए कुछ लोग इसका आण्विक सूत्र HC2H3O2 रूप में लिखते हैं. [1] इसकी संरचना को बेहतर तरीके से दर्शाने के लिए एसिटिक अम्ल को प्राय: CH3-CO2-H, CH3COOH, या CH3CO2H लिखा जाता है. ion एसिटिक अम्ल से हाइड्रोजन धनायन H+ के निकलने से एसिटेट ऋणायन बनता है. एसिटेट नाम का उल्लेख इस ऋणायन से बनने वाले लवण या एसिटिक अम्ल के एक एस्टर के लिए कर सकते हैं.
इतिहास
पुरातन सभ्यता में सिरका को, बीयर और वाइन के हवा के संपर्क में आने का प्राकृतिक परिणाम माना जाता था क्योंकि, एसिटिक अम्ल उत्पन्न करने वाले जीवाणु पूरे विश्व में मौजूद हैं.
रसायन विद्या में एसिटिक अम्ल का उपयोग ई. पू. तीसरी शताब्दी में भी किया जाता था, जब ग्रीक दार्शनिक थियोफ्रेसस ने बताया कि कैसे सिरका और धातुओं की क्रिया से कला में उपयोगी रंगों, सफेद सीसा (लेड कार्बोनेट) और वर्डिग्रीस , [[कॉपर(II) एसिटेट|कॉपर(II) एसिटेट]] समेत ताम्र लवणों के हरे मिश्रण का निर्माण होता है. प्राचीन रोम में कड़वी वाइन को सीसे के बर्तनों में उबाल कर एक बहुत ही मीठा शर्बत सापा बनाया जाता था. सापा लेड एसीटेट से भरपूर था, जोकि एक मीठा पदार्थ था, जिसे की सीसे की शक्कर या साटम की चीनी कहा जाता था और जिसने रोमन कुलीन तंत्र में सीसे का ज़हर फैलाने में भागीदारी निभाई. [2]
मुस्लिम कीमियागर जबीर इब्न हय्यान(गैबर) ने 8वीं सदी में पहली बार आसवन द्वारा सिरका से एसिटिक अम्ल अलग किया. पुनर्जागरण के समय कुछ धातु एसिटेट(मुख्य रूप से कॉपर(II) एसिटेट) के सूखे आसवन से ग्लेशियल एसिटिक अम्ल बनाया गया. 16वीं शताब्दी में जर्मन कीमियागर एन्ड्रीस लिबावियस ने ऐसी ही एक विधी का वर्णन किया और उसने इस तरह से बने ग्लेशियल एसिटिक अम्ल की तुलना सिरका से बने अम्ल से की. सिरका में जल की मौजूदगी से एसिटिक अम्ल के गुणों पर इतना गहरा प्रभाव पड़ता है कि सदियों तक रसायनशास्त्री ग्लेशियल एसिटिक अम्ल और सिरका से बने अम्ल को दो अलग पदार्थ मानते रहे. फ्रांसिसी रसायनशास्त्री पियरे एडेट ने उन्हे समान साबित किया. [2]

1847 में जर्मन रसायनज्ञ हरमन कोल्बे ने पहली बार अकार्बनिक पदार्थों से एसिटिक अम्ल संश्लेषित किया. इस क्रिया अनुक्रम में कार्बन डीसल्फाइड के क्लोरीनीकरण से कार्बन टेट्राक्लोराइड, फिर पायरोलिसिस से टेट्राक्लोरोइथेलीन और जलीय क्लोरीनीकरण से ट्राइक्लोरोएसिटिक अम्ल और अन्त में वैद्युत अपघटन से एसिटिक अम्ल का निर्माण होता है. [3]
1910 तक ज्यादातर ग्लेशियल एसिटिक अम्ल लकड़ी के आसवन द्वारा बने "पायरोलिग्नियस शराब" से बनाया जाता था. चूने के दूध के साथ क्रिया करा कर एसिटिक अम्ल को अलग किया जाता था और प्राप्त केल्सियम एसिटेट को सल्फ्यूरिक अम्ल से अम्लीयकृत करके एसिटिक अम्ल प्राप्त किया जाता था. उस समय जर्मनी 10 हज़ार टन ग्लैशियल एसिटिक अम्ल बना रही थी जो इंडिगो डाई के उत्पादन में प्रयुक्त एसिटिक अम्ल का करीब 30 प्रतिशत था. [2][4]
रासायनिक गुण

कार्बोक्ज़िलिक अम्लों जैसे कि एसिटिक अम्ल के कार्बोक्जिल वर्ग(−COOH) का हाइड्रोजन(H) परमाणु को H+ आयन(प्रोटोन) के रूप में छोड़ देने की क्षमता उन्हे अम्लीय गुण प्रदान करती है. एसिटिक अम्ल 4.75 pKa मूल्य के साथ एक कमजोर अम्ल है, क्योंकि ये जलीय विलयन में प्रभावी रूप से मोनोप्रोटिक अम्ल है. एसिटेट(CH3COO−) इसका संयुग्मी क्षार है. एक 1.0 M विलयन (घरेलू सिरका जैसी सघनता) का pH 2.4 होना ये दर्शाता है कि एसिटिक अम्ल के केवल 0.4% अणु ही विभाजित हुए हैं.

एसिटिक अम्ल की क्रिस्टलीय संरचना दर्शाती है कि अणु हाइड्रोजन बंध द्वारा डायमरों में जोड़ा बना कर रहते हैं. [5] 120 डिग्री सेल्सियस पर बनने वाली वाष्प में भी डायमरों का पता लगाया जा सकता है. गैर-हाइड्रोजन बंध वाले विलायकों में बने तरल विलयन में भी ये मौजूद होते हैं और कुछ मात्रा में शुद्ध एसिटिक अम्ल में भी, [6] लेकिन हाइड्रोजन बंध वाले विलायकों में ये बाधित हो जाते हैं. डायमर की पृथक्करण तापीय धारिता 65.0–66.0 किलो जूल प्रति मोल और पृथक्करण उत्क्रम माप 154–157 J मोल −1 K−1 मापा गया है. [7] दूसरे निचले कार्बोक्जिलिक अम्लों में भी ये डायमरीकरण पाया जाता है.
तरल एसिटिक अम्ल एथेनॉल और जल की तरह एक हाइड्रोफिलिक(ध्रुवीय) प्रोटिक विलायक है. 6.2 की एक उदार तुलनात्मक स्थैतिक परमिटिविटी(द्विवैद्युत स्थिरांक) के साथ ये न सिर्फ ध्रुवीय यौगिकों जैसे कि अकार्बनिक लवणों और शर्करा बल्कि अध्रुवीय यौगिकों जैसे तेल और सल्फर व आयोडीन जैसे अवयवों को भी घोल सकती है. ये ध्रुवीय और अध्रुवीय विलायकों जैसे जल, क्लोरोफॉर्म और हैक्सेन के साथ तत्काल मिश्रित हो जाती है. उच्च एल्केनों के साथ एसिटिक अम्ल (ऑक्टेन से शुरू होने वाले) पूरी तरह से नहीं मिल पाता है और मिलने की ये योग्यता लंबे n-एल्केनों के साथ घटती जाती है. [8] एसिटिक अम्ल का घुलने और मिलने का ये गुण इसे व्यापक तौर से इस्तेमाल किये जाने वाला औद्योगिक रसायन बनाता है.
रासायनिक क्रियाएं
एसिटिक अम्ल लोहा, मैग्नीशियम और ज़िंक समेत धातुओं के लिए संक्षारक है और हाइड्रोजन गैस बनाता है और धातु लवण जिन्हे एसिटेट कहा जाता है. एल्युमीनियम ऑक्सीज़न के संपर्क में आने पर इसकी सतह पर एल्यूमीनियम ऑक्साइड की एक पतली परत बनाता है जो कि तुलनात्मक रूप से अम्ल प्रतिरोधी होती है इसी कारण एसिटिक अम्ल का परिवहन एल्यूमीनियम टैंकों में किया जाता है. एसिटिक अम्ल और एक उचित क्षार से भी मैटल एसिटेट बनाए जा सकते हैं, जैसा की विख्यात "बेकिंग सोडा + सिरका" क्रिया में होता है. क्रोमियम(II) एसिटेट के उल्लेखनीय अपवाद को छोड़ कर बाकी सारे एसीटेट जल में विलयशील होते हैं.
- NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + CO2(g) + H2O(l)
एसिटिक अम्ल, कार्बोक्जिलिक अम्ल की विशिष्ट रासायनिक अभिक्रियाओं से गुज़रता है जैसे एल्केली से क्रिया करते हुए पानी और एक धातु इथेनोएट बनाता है, एक धातु से क्रिया करके धातु इथेनोएट बनाता है और जब कार्बोनेटों तथा हाइड्रोजन कार्बोनेटों से क्रिया कराई जाए तो एक धातु इथेनोएट, जल तथा कार्बन डाइ ऑक्साइड बनाता है. इनमें सबसे उल्लेखनीय अभिक्रिया है न्यूनीकरण द्वारा इथेनॉल बनाना और न्यूक्लिओफिलिक एसिल प्रतिस्थापन द्वारा एसिटाइल क्लोराइड जैसे यौगिक बनाना. दूसरे प्रतिस्थापन यौगिकों में [[एसिटिक एनहाइड्राइड|एसिटिक एनहाइड्राइड]] शामिल है जो एसिटिक अम्ल के दो अणुओं में से जल के निकल जाने से बनता है. इसी तरह फिशर एस्टरीकरण द्वारा एसिटिक अम्ल के एस्टर और मध्यस्थ बनाए जा सकते हैं. 440°C से ऊपर गर्म करने पर एसिटिक अम्ल विघटित होकर कार्बन डाइ ऑक्साइड और मिथेन या जल और इथेनॉल बनाता है.
एसिटिक अम्ल अपनी विशेष गंध से पहचाना जा सकता है. एसिटिक अम्ल के लवणों के लिए एक रंगीन क्रिया है आयरन(III) क्लोराइड विलयन, जिसके परिणामस्वरूप गहरा लाल रंग बनता है जो अम्लीकरण के बाद गायब हो जाता है. आर्सेनिक ट्राइऑक्साइड के साथ गर्म किये जाने पर एसीटेट काकोडाइल ऑक्साइड बनाते हैं जिसका उसकी बदबूदार वाष्प के कारण पता लगाया जा सकता है.
जीवरसायन
एसिटिक अम्ल से व्युत्पन्न एसिटाइल वर्ग जीवन के सभी रूपों के जैव रसायन का मौलिक आधार है. कोएन्ज़ाइम A के साथ बंध बनाने पर ये कार्बोहाइड्रेट और वसा के चयापचय का केंद्र बन जाता है. हालांकि कोशिकाओं के अवयवों के pH के नियंत्रण में बाधाओं से बचने के लिए कोशिकाओं में मुक्त एसिटिक अम्ल की सांद्रता को निचले स्तर पर रखा जाता है. लंबी श्रृंखला वाले कार्बोक्जिलिक अम्लों (मोटे अम्लों) की तरह एसिटिक अम्ल प्राकृतिक ट्राइग्लिसराइड में नहीं मिलता है. हालांकि कृत्रिम ट्राइग्लिसराइड ट्राइएसिटिन (ग्लिसरीन ट्राइएसिटेट) एक आम खाद्य योजक है और सौंदर्य प्रसाधन और सामयिक दवाओं में पाया जाता है.
एसिटिक अम्ल का उत्पादन और उत्सर्जन एसिटिक एसिड जीवाणुओं विशेषकर एसीटोबेक्टर जीनस और क्लोस्ट्रीडियम एसिटोब्यूटाइलिकम द्वारा किया जाता है. ये जीवाणु सार्वभौमिक रूप से खाद्य पदार्थों, जल और मिट्टी में पाये जाते हैं और फलों और दूसरे खाद्य पदार्थों के सड़ने से एसिटिक अम्ल का उत्पादन स्वाभाविक रूप से होता है. मनुष्यों और दूसरे स्तनपाइयों में एसिटिक अम्ल योनि स्नेहक का एक हिस्सा होता है, जहां कि ये एक हल्के एंटिबायोटिक एजेंट के रूप में कार्य करता है.
उत्पादन

एसिटिक अम्ल को कृत्रिम रूप से और जीवाणुओं के किण्वन, दोनों तरीकों से उत्पादित किया जाता है. आज विश्व उत्पादन का लगभग 10 प्रतिशत जैविक मार्ग से बनाया जाता है लेकिन ये महत्वपूर्ण है क्योंकि कई देशों के खाद्य शुद्धता कानूनों की बाध्यता है कि खाद्य पदार्थों में प्रयुक्त होने वाला सिरका जैविक मूल का होना चाहिए, रसायन उद्योगों में प्रयुक्त होने वाले एसिटिक अम्ल का 75% मिथेनॉल कार्बोनाइलिकरण से बनाया जाता है जिसे नीचे समझाया गया है. शेष के लिए वैकल्पिक तरीकों का प्रयोग किया जाता है. [9] शुद्ध एसिटिक अम्ल का कुल वैश्विक उत्पादन 50 लाख टन प्रति वर्ष आंका गया है जिसका करीब आधा हिस्सा संयुक्त राज्य में उत्पादित होता है. यूरोपीय उत्पादन 1 Mt/a के करीब है जिसमें गिरावट आ रही है और जापान का उत्पादन 0.7 Mt/a प्रति वर्ष है. प्रतिवर्ष पुनर्नवीनीकरण से प्राप्त 1.5 Mt को मिलाकर विश्व बाजार में एसिटिक अम्ल का कुल उत्पादन 6.5 Mt/a है. [10][11] शुद्ध एसिटिक अम्ल के दो सबसे बड़े निर्माता सीलेनीज और BP केमिकल्स हैं. दूसरे बड़े निर्माताओं में मिलेनियम केमिकल्स, स्टर्लिंग केमिकल्स, सैमसंग, ईस्टमैन और वैंन्सक इटेनोल्केमी शामिल हैं.
मिथेनॉल कार्बोनाइलिकरण
ज्यादातर शुद्ध एसिटिक अम्ल मिथेनॉल कार्बोनाइलिकरण से बनाया जाता है. इस प्रक्रिया में रसायनिक समीकरण के अनुसार मिथेनॉल और कार्बन मोनोऑक्साइड क्रिया कर एसिटिक अम्ल बनाते हैं.
- CH 3 OH + CO → CH 3COOH
ये प्रक्रिया तीन पदों में संपन्न होती है और इसमें एक मध्यवर्ती के रूप में आयोडोमीथेन बनता है. कार्बोनाइलिकरण की क्रिया में उत्प्रेरक के लिए आमतौर पर एक जटिल धातु की जरूरत पड़ती है (स्टेप 2).
- CH 3 OH + HI → CH 3I + H2O
- CH3I + CO → CH3COI
- CH3COI + H2O → CH3COOH + HI
प्रक्रिया की परिस्थितियों में फेर बदल करके एक ही संयंत्र में एसिटिक एन्हाइड्राइड भी बनाया जा सकता है. क्योंकि मिथेनॉल और कार्बन मोनोऑक्साइड दोनों ही कच्चा माल हैं, एसिटिक अम्ल के उत्पादन के लिए मिथेनॉल कार्बोनाइलीकरण लंबे समय से एक आकर्षक विधि रही है. ब्रिटिश सिलेनीज के हेनरी ड्रेफियस ने सन् 1925 में मिथेनॉल कार्बोनाइलिकरण का प्रायोगिक संयंत्र विकसित किया था. [12] हालांकि व्यावहारिक सामग्री की कमी जो कि संक्षारक प्रतिक्रिया मिश्रण को आवश्यक उच्च दाब (200 atm या ज्यादा ) पर रख सके की कमी ने इसके व्यावसायिकरण को हतोत्साहित किया. सर्वप्रथम 1963 में जर्मन रसायन कंपनी BASF के द्वारा वाणिज्यिक मिथेनॉल कार्बोनाइलिकरण प्रक्रिया विकसित की गई जिसमें कोबाल्ट उत्प्रेरक का उपयोग किया गया. 1968 में एक रोडियम आधारित उत्प्रेरक (cis −[Rh(CO)2I2]−) का ईजाद किया गया जो प्रक्रिया को बिना किसी सहउत्पाद के कम दबाव पर कुशलतापूर्वक संचालित कर सकता था. इस उत्प्रेरक का उपयोग करते हुए सन् 1970 में US रसायन मोन्सेंटो कंपनी ने पहला संयंत्र स्थापित किया और रोडियम उत्प्रेरित मिथेनॉल कार्बोनाइलिकरण एसिटिक अम्ल के उत्पादन का सबसे प्रमुख तरीका बन गया(मोन्सेंटो प्रक्रिया देखें). 1990 के दशक के अंत में रसायन कंपनी BP कैमिकल्स ने रूथेनियम के द्वारा उन्नत केटिवा उत्प्रेरक ([Ir(CO)2I2]−) का वाणिज्यिकरण किया. ये इरिडियम-उत्प्रेरित केटिवा प्रक्रिया ज्यादा हरित और कुशल है [13] और इसने बड़े पैमाने पर अक्सर उन्ही संयंत्रों में मोन्सेंटो प्रक्रिया को प्रतिस्थापित कर दिया.
एसीटैल्डिहाइड ऑक्सीकरण
मोन्सेंटो प्रक्रिया के व्यावसायीकरण से पहले ज्यादातर एसिटिक अम्ल एसिटैल्डिहाइड के ऑक्सीकरण से बनाया जाता था. ये दूसरी सबसे महत्वपूर्ण निर्माण पद्धति रही है हालांकि ये मिथेनॉल कार्बोनाइलेशन के साथ प्रतिस्पर्धा नहीं कर सकती.
एसीटैल्डिहाइड को ब्यूटेन या हल्के नेफ्था के ऑक्सीकरण या इथाइलीन के हाइड्रेशन से बनाया जा सकता है. रासायनिक समीकरण के अनुसार जब ब्यूटेन या हल्का नेफ्था को हवा के साथ विभिन्न धातु आयनों जिनमें मैंगनीज, कोबाल्ट और क्रोमियम शामिल हैं की उपस्थिति में गर्म किया जाता है तो प्रिऑक्साइड बनते हैं और उनके विघटन से एसिटिक अम्ल बनता है.
- 2 C4H10 + 5 O2 → 4 CH3COOH + 2 H2O
आमतौर पर यह अभिक्रिया ब्यूटेन को तरल बनाए रखते हुए ताप और दाब के संयोजन को अधिक से अधिक गर्म रखते हुए संचालित की जाती है. विशिष्ट अभिक्रिया परिस्थितियां 150 डिग्री सेल्सियस और 55 atm हैं. ब्यूटेनोन, एथाइल एसीटेट, फोर्मिक अम्ल और प्रोपिओनिक अम्ल समेत सह उत्पाद भी बन सकते है. ये सह उत्पाद भी वाणिज्यिक रूप से मूल्यवान हैं और अगर ये आर्थिक रूप से उपयोगी हैं तो इनका ज्यादा मात्रा में उत्पादन करने के लिए अभिक्रिया परिस्थितियों को परिवर्तित किया जा सकता है. हालांकि इन सह उत्पादों से एसिटिक अम्ल को अलग करने की प्रक्रिया, लागत को बढ़ा देती है.
ब्यूटेन के ऑक्सीकरण के लिए उपयोगी परिस्थितियों और उत्प्रेरकों को इस्तेमाल कर हवा की ऑक्सीजन से एसीटेल्डिहाइड का ऑक्सीकरण कर एसिटिक अम्ल बनाया जा सकता है.
- 2 CH3CHO + O2 → 2 CH3COOH
आधुनिक उत्प्ररकों के इस्तेमाल से इसी अभिक्रिया द्वारा एसिटिक अम्ल की उपज बढ़ाई जा सकती है. इसमें बनने वाले प्रमुख सह उत्पादों इथाइल एसीटेट, फोर्मिक अम्ल और फोर्मेल्डिहाइड के क्वथनांक एसिटिक अम्ल से कम होते हैं और इन्हे आसवन द्वारा आराम से अलग कर लिया जाता है. [14]
इथाइलीन ऑक्सीकरण
एथिलीन से एसीटैल्डिहाइड वेकर प्रक्रिया से भी बनाया जा सकता है और फिर ऊपर दर्शाई विधि अनुसार ऑक्सीकृत किया जा सकता है. हाल ही में रसायन कंपनी शोवा डेंको जिसने 1997 में जापान के ओइटा में एक एथाइलीन ऑक्सीकरण संयंत्र खोला था ने इथाइलीन से एसिटिक अम्ल रूपांतरण की एक सस्ती एकल चरण प्रक्रिया का व्यावसायिकरण किया. [15] ये प्रक्रिया एक पैलेडियम धातु उत्प्रेरक की सहायता से एक हिटरोपॉली अम्ल जैसे कि टंगैस्टोसिलिसिक अम्ल पर की गई. इथाइलीन कि स्थानीय कीमतों पर निर्भर करते हुए इसे छोटे संयंत्रों(100-250 किलो टन प्रतिवर्ष) के लिए मिथेनॉल कार्बोनाइलीकरण का प्रतिस्पर्धी माना गया.
ऑक्सीडेटिव किण्वन
मानव इतिहास का ज्यादातर एसिटिक अम्ल जीनस एसीटोबैक्टर जीवाणुओं द्वारा सिरका के रूप में बनाया गया. पर्याप्त ऑक्सीजन दिये जाने पर ये जीवाणु विभिन्न एल्कोहॉली भोज्य पदार्थों से सिरका का निर्माण कर सकते हैं. सामान्यतया उपयोग में लिए जाने वाले चारे में सेब का आसव, शराब और किण्वित अनाज, जौ, चावल या आलू का गूदा शामिल हैं. इन जीवाणुओं द्वार संपंन्न की जाने वाली रसायनिक अभिक्रिया कुल मिलाकर इस तरह है:
- C2H5OH + O2 → CH3COOH + H2O
शराब के एक तरल विलयन में एसीटोबैक्टर जीवाणु डाल कर उसे एक गर्म, हवादार स्थान पर रखने से कुछ महीनों में सिरका तैयार होता है. औद्योगिक सिरका निर्माण विधि में इस प्रक्रिया को जीवाणु के लिए ऑक्सीजन आपूर्ति को बढ़ा कर तेज कर दिया जाता है.
शायद शराब निर्माण प्रक्रिया में हुई किसी गलती के कारण किण्वण द्वारा प्रथम बार सिरका बना. अगर बहुत ज्यादा तापमान पर किण्वन हो रहा है तो अंगूरों पर स्वाभाविक तौर पर आया खमीर एसीटोबैक्टर से जरूर भर जायेगा. जैसे जैसे खाद्य, चिकित्सा औऱ स्वच्छता के लिए सिरका की मांग बढ़ी अंगूर की शराब के व्यापारियों ने अंगूरों के परिपक्व होने और शराब निर्मित करने लायक होने से पहले गर्मी के महीनों में दूसरे कार्बनिक पदार्थों से सिरका बनाना सीख लिया. हालांकि ये पद्धति धीमी थी और हमेशा सफल नहीं होती थी क्योंकि शराब के व्यापारी प्रक्रिया को समझ नहीं पाये थे. [16]
जर्मनी में 1823 से पहले काम में ली गयी "तीव्र विधि" या "जर्मन विधि" सबसे पहली आधुनिक वाणिज्यिक प्रक्रियाओं में से एक थी. इस प्रक्रिया में लकड़ी की कतरन या कोयले से बंद एक गुंबज में किण्वन की क्रिया होती है. शराब से भरी फीड गुंबज के शीर्ष से धीरे धीरे अंदर गिराई जाती है और ताजा हवा की आपूर्ती नीचे से या तो प्राकृतिक या कृत्रिम संवहन द्वारा की जाती है. हवा की आपूर्ति में सुधार से सिरका निर्माण की ये प्रक्रिया महीनों की बजाय हफ्तों में संपन्न हो जाती है. [17]
आजकल ज्यादातर सिरका जलमग्न टैंक संस्कृति में बनाया जाता है जिसका वर्णन 1949 में औट्टो ह्रोमोट्का और हैनरिच एब्नर ने किया. [18] इस विधि में लगातार विलोड़ित की जाती हुई टंकी के विलयन में हवा के बुलबुलों द्वारा ऑक्सीजन की आपूर्ती करते हुए शराब को किण्वित कर सिरका में बदला जाता है. इस विधि के आधुनिक अनुप्रयोगों को इस्तेमाल करते हुए बैच प्रक्रिया द्वारा 15 प्रतिशत एसिटिक अम्ल का सिरका केवल 24 घंटों में तैयार किया जा सकता है यहां तक 20 प्रतिशत केवल 60 घंटों में फैड – बैच प्रक्रिया से बनाया जा सकता है. [16]
वात निरपेक्ष किण्वन
जीनस क्लोस्ट्रीडियम समेत वात निरपेक्ष जीवाणुओं की प्रजातियां ईथेनॉल की मध्यस्थता के बगैर ही शक्कर को सीधे एसिटिक अम्ल में बदल सकती हैं. इन जीवाणुओं द्वारा की जाने वाली पूरी रासायनिक क्रिया को निम्न प्रकार दर्शाया जा सकता है:
- C6H12O6 → 3 CH3COOH
औद्योगिक रसायनज्ञों के दृष्टिकोण से ये एसीटोजेनिक जीवाणु और ज्यादा दिलचस्प हैं क्योंकि ये मेथेनॉल, कार्बन मोनोऑक्साइड या कार्बन डाइऑक्साइड और हाइड्रोजन के एक मिश्रण समेत एक-कार्बन यौगिकों से एसिटिक अम्ल निर्मित कर सकते हैं:
- 2 CO2 + 4 H2 → CH3COOH + 2 H2O
क्लोस्ट्रीडियम की सीधे शक्कर या सस्ते आदानों के इस्तेमाल से एसिटिक अम्ल बनाने की क्षमता ये बताती है कि ये जीवाणु ईथेन ऑक्सीकारकों जैसे एसीटोबैक्टर से ज्यादा कुशलता से एसिटिक अम्ल बना सकते हैं. हालांकि क्लोस्ट्रीडियम जीवाणु एसीटोबैक्टर की तुलना में कम अम्ल सहिष्णु हैं. यहां तक की सबसे ज्यादा अम्ल सहिष्णु क्लोस्ट्रीडियम उपभेद केवल कुछ प्रतिशत एसिटिक अम्ल वाला सिरका बना सकता है जबकि एसिटोबैक्टर उपभेद 20 प्रतिशत तक एसिटिक अम्ल वाला सिरका बना सकता है. वर्तमान में एसीटोबैक्टस के इस्तेमाल से सिरका बनाना क्लोस्ट्रीडियम के इस्तेमाल से सिरका बना कर उसे सांद्र करने से ज्यादा सस्ता है. परिणामस्वरूप हालांकि एसिटोजेनिक जीवाणु 1940 से ज्ञात होने के बावजूद उनका औद्योगिक इस्तेमाल कुछ आला अनुप्रयोगों तक ही सीमित रहा है. [19]
अनुप्रयोग

एसिटिक अम्ल रासायनिक यौगिकों के निर्माण के लिए एक रासायनिक अभिकर्मक है. एसिटिक एनहाइड्राइड और एस्टर के अलावा अकेले विनाइल एसिटेट एकलक के निर्माण में ही एसिटिक अम्ल का सबसे बड़ा उपयोग होता है. सिरका में एसिटिक अम्ल का उपयोग तुलनात्मक रूप से कम है. [11]
विनाइल एसीटेट एकलक
विनाइल एसीटेट एकलक (VAM) के निर्माण में एसिटिक अम्ल का प्रमुख उपयोग होता है. ये अनुप्रयोग एसिटिक अम्ल के वैश्विक उत्पादन का 40 से 45 प्रतिशत उपयोग में ले लेता है. पैलेडियम उत्प्रेरक की उपस्थिति में इथाइलीन और एसिटिक अम्ल की ऑक्सीजन से अभिक्रिया होती है.
- 2 H3C-COOH + 2 C2H4 + O2 → 2 H3C-CO-O-CH=CH2 + 2 H2O
विनाइल एसीटेट पॉलीविनाइल एसीटेट या दूसरे बहुलकों में बहुलित हो सकता है जो कि रंग और गोंद बनाने के काम में आते हैं.
एस्टर उत्पादन
एसिटिक अम्ल के प्रमुख एस्टर सामान्यत: स्याही, रंगों और परतों के विलायक बनाने के काम आते हैं. इथाइल एसीटेट, n-ब्यूटाइल एसीटेट, आइसोब्यूटाइल एसीटेट और प्रोपाइल एसीटेट एस्टर में इसमें शामिल हैं. ये आम तौर पर एसिटिक अम्ल और संबंधित अल्कोहल की उत्प्रेरित अभिक्रियाओं द्वारा उत्पादित किये जाते हैं:
- H3C-COOH + HO-R → H3C-CO-O-R + H2O, (R = एक सामान्य एल्काइल समूह)
हालांकि ज्यादातर एसीटेट एस्टर एसीटलडिहाइड का इस्तेमाल करते हुए टाइशेंको अभिक्रिया द्वारा उत्पादित किये जाते हैं. इसके अतिरिक्त ईथर एसीटेट का उपयोग निट्रोसेल्यूलोज, एक्रेलिक रोगन, वार्निश और लकड़ी के दागों के विलायक के रूप में किया जाता है. पहले ईथाइलीन ऑक्साइड या प्रोपाइलीन ऑक्साइड के साथ एल्कोहॉल की क्रिया से ग्लाइकॉल मोनोईथर बनाया जाता है जिसे फिर एसिटिक अम्ल के साथ एस्टरीकृत किया जाता है. तीन प्रमुख उत्पाद हैं, इथाइलीन ग्लाइकॉल मोनोइथाइलीन ईथर एसीटेट (EEA), इथाइलीन ग्लाइकॉल मोनोब्यूटाइलीन ईथर एसीटेट (EBA) और प्रोपाइलीन ग्लाइकॉल मोनोमिथाइल ईथर एसीटेट (PMA). ये अनुप्रयोग एसिटिक अम्ल के वैश्विक उत्पादन का 15 से 20 प्रतिशत उपभोग में ले लेता है. ईथर एसीटेट, उदाहरण के लिए EEA मानव प्रजनन के लिए हानिकारक बताया गया है. [11]
एसिटिक एनहाइड्राइड
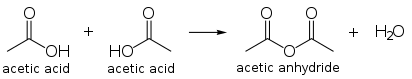
एसिटिक एनहाइड्राइड, एसिटिक अम्ल के दो अणुओं का संघनित उत्पाद है. एसिटिक एनहाड्राइड का वैश्विक उत्पादन एक प्रमुख अनुप्रयोग है और ये एसिटिक अम्ल के वैश्विक उत्पादन का करीब 25 से 30 प्रतिशत काम में लेता है. एसिटिक एनहाइड्राइड अम्ल के बिना ही मिथेनॉल कार्बोनिलिकरण के द्वारा सीधा बनाया जा सकता है और एनहाइड्राइड उत्पादन के लिए कैटिवा उत्पादन संयंत्र का उपयोग किया जा सकता है.
एसिटिक एनहाइड्राइड एक मजबूत एसिटिलिकरण घटक है. जैसे इसका मुख्य उपयोग सैल्यूलोज एसिटेट जो कि एक कृत्रिम कपड़ा है जो फोटोग्राफी फिल्म बनाने के काम भी लिया जाता है के लिए है. एसिटिक एनहाइड्रिडाइड एस्प्रिन, हैरोइन और दूसरे यौगिक बनाने का एक अभिकर्मक भी है.
सिरका
सिरका के रूप में एसिटिक अम्ल विलयन (आमतौर पर 4 से 18 प्रतिशत एसिटिक अम्ल, प्रतिशत बड़े पैमाने पर परिकलित किया जाता है) सीधे तौर पर एक मसाले के रूप में और सब्जियों एवं दूसरे खाद्य पदार्थों के अचारीकरण में प्रयुक्त होता है. मेज पर प्रयुक्त होने वाला सिरका साधारणत: पतला(4 से 8 प्रतिशत एसिटिक अम्ल) होता है, जबकि वाणिज्यिक खाद्य अचारीकरण के लिए प्रयुक्त किया जाने वाला विलयन ज्यादा सघन होता है. सिरका के रूप में प्रयुक्त होने वाले एसिटिक अम्ल की मात्रा वैश्विक पैमाने पर बहुत ज्यादा नहीं है, लेकिन ऐतिहासिक दृष्टि से ये अब तक का सबसे पुराना और सबसे ज्ञात अनुप्रयोग है.
विलायक के रूप में प्रयोग
ग्लैशियल एसिटिक अम्ल जैसा कि ऊपर उल्लेख किया गया है एक उत्कृष्ट ध्रुवीय प्रोटिक विलायक है. ये कार्बनिक यौगिकों का पुनःर्क्रिस्टलीकरण कर उन्हे शुद्ध करने के लिए एक विलायक के रूप में सतत रूप से प्रयोग में लिया जाता रहा है. टैरेफ्थेलिक अम्ल (TPA) जो कि पॉलिइथाइलीन टेरफ्थेलेट (PET) के लिए कच्चा माल है के उत्पादन में शुद्ध एसिटिक अम्ल एक विलायक की तरह काम में लिया जाता है. हालांकि वर्तमान [कब?] में इस विशेष अनुप्रयोग के लिए दुनिया भर में 5से 10 प्रतिशत एसिटिक अम्ल का उपयोग हो रहा है जो अगले दशक में PET के उत्पादन में बढ़ौतरी के साथ धीरे-धीरे बढ़ने का अनुमान है. [11]
एसिटिक अम्ल अक्सर ऐसी अभिक्रियाओं जिनमें कार्बोकेशन होता है, जैसे कि फ्रिडेल-क्राफ्ट एल्केलिकरण के लिए विलायक के तौर पर उपयोग में लिया जाता है. उदाहरण के लिए कृत्रिम कपूर के वाणिज्यिक उत्पादन के एक चरण में कैंफीन के आइसोबोर्निल एसीटेट में वैग्नर – मीरवैन पुनर्व्यवस्थन, यहां एसिटिक अम्ल पुनर्व्यवस्थित कार्बोकरण के लिए एक जाल और एक विलायक दोनों की तरह काम करता है. कार्बन पर पैलेडियम के उपयोग से एक एरिल नाइट्रो – समूह के एनिलिन में विघटित होने कि क्रिया में एसिटिक अम्ल एक पसंदीदा विलायक होता है.
ग्लैशियल एसिटिक अम्ल कमजोर एल्केलाइन पदार्थों जैसे कि कार्बनिक मध्यस्थों के आकलन के लिए विश्लेषणात्मक रसायन विज्ञान में काम में लिया जाता है. ग्लैशियल एसिटिक अम्ल जल से ज्यादा कमजोर क्षार है इसीलिए मध्यस्थ इस माध्यम में एक मजबूत क्षार की तरह व्यवहार करते हैं. ये तब एक बहुत तेज अम्ल जैसे कि परक्लोरिक अम्ल के ग्लैशियल एसिटिक अम्ल में विलयन बनाकर अनुमापित किया जा सकता है.
अन्य अनुप्रयोग
एसिटिक अम्ल की हलकी अम्लता के कारण इसके तनु विलयनों का प्रयोग किया जाता है. उदाहरण के लिए घरों में फोटोग्राफिक फिल्म के विकास के दौरान एक स्टॉप बाथ के रूप में और कंदीलों और केतलियों के लाइमस्केल को हटाने के लिए डीस्केलिंग घटक के रूप में.
ग्लैशियल एसिटिक अम्ल का तनु विलयन चिकित्सकीय प्रयोगशालाओं में सफेद रक्त कोशिकाओं को गिनने के लिए लाल रक्त कोशिकाओं को घोलने में किया जा सकता है. इसका दूसरा नैदानिक प्रयोग उन लाल रक्त कोशिकाओं को घोलने के लिए है जो सूक्ष्म परीक्षण के दौरान मूत्र के दूसरे महत्वपूर्ण घटकों को अस्पष्ट कर सकती है.
अम्लता का उपयोग बॉक्स जैलिफिश के डंक के उपचार के लिए किया जाता है जिसमें जैलिफिश के चुभने वाली कोशिकाओं को अक्षम कर दिया जाता है, अगर तुरंत लगाया जाये तो गंभीर चोट या मृत्यु से बचा जा सकता है और लोगों में कानों के बाहरी संक्रमण के उपचार के लिए वोसोल जैसी दवाइयां बनाने में. इसी तरह एसिटिक अम्ल पशुओं के लिए परिरक्षित चारे को संरक्षित रखने के लिए उस पर छिड़कने के काम आता है ताकि उसमें जीवाणुओं और कवकों का विकास ना हो. ग्लैशियल एसिटिक अम्ल दाग औऱ मस्सा हटाने के काम भी आता है.
एसिटिक अम्ल से निम्न सहित कार्बनिक या अकार्बनिक लवणों का निर्माण किया जाता है:
- सोडियम एसीटेट - कपड़ा उद्योग में और खाद्य संरक्षक (E262) के रूप में उपयोग किया जाता है.
- कॉपर(II) एसिटेट - एक रंजक और एक कवकनाशी के रूप में उपयोग किया जाता है.
- एल्यूमीनियम एसीटेट और आयरन(II) एसीटेट – रंजकों को और तीव्र बनाने के रूप में उपयोग किया जाता है.
- पैलेडियम(II) एसीटेट – कार्बनिक युग्मी क्रियाओं जैसे हैक अभिक्रिया के लिए उत्प्रेरक के रूप में उपयोग किया जाता है.
- सिल्वर एसीटेट - एक कीटनाशी के रूप में उपयोग किया जाता है.
वैकल्पिक एसिटिक अम्लों का उत्पादन में शामिल हैं:
- मोनोक्लोरोएसिटिक अम्ल(MCA), डाइक्लोरोएसिटिक अम्ल(एक सहउत्पाद माना जाता है) और ट्राईक्लोरोएसिटिक अम्ल. MCA इंडिगो रंजक के उत्पादन में प्रयुक्त किया जाता है.
- ब्रोमोएसिटिक अम्ल जिसका एस्टरीकृत करके इथाइल ब्रोमोएसिटेट अभिकर्मक बनाया जाता है.
- ट्राईफ्लोरोएसिटिक अम्ल, जो कि कार्बनिक संश्लषण में एक आम अभिकर्मक है.
वैश्विक स्तर पर इन सभी अनुप्रयोगों में एक साथ इस्तेमाल किये गये एसिटिक अम्ल (TPA को छोड़ कर) की मात्रा 5 से 10 प्रतिशत होती है. हालांकि एसी उम्मीद नहीं की जाती कि ये अनुप्रयोग TPA के उत्पादन जितना बढ़ेंगे. [11] पतला एसिटिक अम्ल आयन्टोफोरेसिस के माध्यम से दागी ऊतक के पिंडों को तोड़कर शारिरिक चिकित्सा के काम आते हैं.
सुरक्षा
सांद्र एसिटिक अम्ल एक संक्षारक है और इसलिए उचित सावधानी के साथ संभाला जाना चाहिए, क्योंकि ये त्वचा जला सकता है, स्थायी रूप से आंख को नुकसान पहुंचा सकता है और श्लेष्मा झिल्ली में जलन कर सकता है. ये जलन और फफोले संपर्क में आने के कई घंटों बाद दिख सकते हैं. लेटेक्स के दस्ताने इससे बचाव नहीं कर सकते इसलिए इस यौगिक का उपयोग करते समय विशेष प्रतिरोधी दस्ताने जैसे निट्राइल रबर से बने दस्ताने पहने जाते हैं. सांद्र अम्ल कठिनाई के साथ प्रयोगशाला में प्रज्वलित किया जा सकता है. अगर परिवेश का तापमान 39 °C (102 °F) से बढ़ जाये तो ये एक ज्वलनशील खतरा बन जाता है और इस तापमान से ऊपर हवा के साथ मिल कर एक विस्फोटक मिश्रण बना सकता है( विस्फोटक सीमायें: 5.4–16%)
एसिटिक अम्ल के विलयनों के खतरे सांद्रता पर निर्भर करते हैं. निम्नलिखित तालिका में एसिटिक अम्ल के विलयनों के EU वर्गीकरण की सूची दी गई है:

| सांद्रता भार के अनुसार |
मोलरता | वर्गीकरण | R-शब्द |
|---|---|---|---|
| 10–25% | 1.67–4.16 mol/L | प्रकोपक (xi) | R36/38 |
| 25-90% | 4.16–14.99 mol/L | नाशक (C) | R34 |
| >90% | >14.99 mol/L | नाशक (C) ज्वलनशील (F) | साँचा:R10 , R35 |
25 प्रतिशत से अधिक सांद्रता वाला एसिटिक अम्ल तीखी और संक्षारक वाष्प की वजह से ढ़क्कन वाले पात्र में रखा जाता है. सिरका के रूप में तनु एसिटिक अम्ल हानिरहित होता है. हालांकि तीव्र विलयन का सेवन मनुष्यों और पशुओं के लिए खतरनाक होता है. ये पाचन तंत्र को गंभीर नुकसान पहुंचा सकता है और रक्त की अम्लता में गंभीर जानलेवा परिवर्तन कर सकता है.
असंगति के कारण एसिटिक अम्ल को क्रोमिक अम्ल, इथाइलीन ग्लाइकॉल, नाइट्रिक अम्ल, परक्लोरिक अम्ल, परमैंगनेटों, परऑक्साइडों औऱ हाइड्रॉक्सिलों से दूर रखने की सलाह दी जाती है.
इन्हें भी देखें
- एसीटल समूह, CH 3-CO - समूह, Ac संक्षिप्त
- शराब में एसिड
- आम रसायन, जहां आम रसायनों खरीद प्रयोगों में इस्तेमाल करने के लिए किया जाता है
- सोडियम साइट्रेट
संदर्भ
- ↑ Akeroyd, F. Michael (1993). "Laudan's Problem Solving Model". The British Journal for the Philosophy of Science. 44 (4): 785–88. डीओआइ:10.1093/bjps/44.4.785.
- ↑ अ आ इ Martin, Geoffrey (1917). Industrial and Manufacturing Chemistry (Part 1, Organic संस्करण). London: Crosby Lockwood. पपृ॰ 330–31.
- ↑ Goldwhite, Harold (2003). "Short summary of the career of the German organic chemist, Hermann Kolbe" (PDF). New Haven Section Bull. Am. Chem. Soc. 20 (3). नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Schweppe, Helmut (1979). "Identification of dyes on old textiles". J. Am. Inst. Conservation. 19 (1/3): 14–23. डीओआइ:10.2307/3179569.
- ↑ Jones, R.E. (1958). "The crystal structure of acetic acid". Acta Crystallogr. 11 (7): 484–87. डीओआइ:10.1107/S0365110X58001341. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद) - ↑ Briggs, James M. (1991). "Monte Carlo simulations of liquid acetic acid and methyl acetate with the OPLS potential functions". J. Phys. Chem. 95: 3315–22. डीओआइ:10.1021/j100161a065. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद) - ↑ Togeas, James B. (2005). "Acetic Acid Vapor: 2. A Statistical Mechanical Critique of Vapor Density Experiments". J. Phys. Chem. A. 109 (24): 5438. PMID 16839071. डीओआइ:10.1021/jp058004j.
- ↑ Zieborak, K. (1958). Bull.Acad.Pol.Sci.Ser.Sci.Chim.Geol.Geogr. 6 (2): 3315–22. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद); गायब अथवा खाली|title=(मदद) - ↑ Yoneda, N. (2001). "Recent advances in processes and catalysts for the production of acetic acid". Applied Catalysis A, General. 221 (1–2): 253–265. डीओआइ:10.1016/S0926-860X(01)00800-6. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद) - ↑ "Production report". Chem. Eng. News: 67–76. 11 July 2005.
- ↑ अ आ इ ई उ Suresh, Bala (2003). "Acetic Acid". Chemicals Economic Handbook. SRI International. पृ॰ 602.5000.
- ↑ Wagner, Frank S. (1978). "Acetic acid". प्रकाशित Grayson, Martin (संपा॰). Kirk-Othmer Encyclopedia of Chemical Technology (3rd संस्करण). New York: John Wiley & Sons.
- ↑ Lancaster, Mike (2002). Green Chemistry, an Introductory Text. Cambridge: Royal Society of Chemistry. पपृ॰ 262–66. आई॰ऍस॰बी॰ऍन॰ 0-85404-620-8.
- ↑ "Acetic acid". National Institute of Standards and Technology. अभिगमन तिथि 2008-02-03.
- ↑ Sano, Ken-ichi (1999). A new process for acetic acid production by direct oxidation of ethylene. Catalyst Surveys from Japan. 3. पपृ॰ 66–60. डीओआइ:10.1023/A:1019003230537. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद) - ↑ अ आ Otto Hromatka and Heinrich Ebner (1959). "Vinegar by Submerged Oxidative Fermentation". Ind. Eng. Chem. 51 (10): 1279–1280. डीओआइ:10.1021/ie50598a033.
- ↑ Everett P. Partridge (1931). "Acetic Acid and Cellulose Acetate in the United States A General Survey of Economic and Technical Developments". Ind. Eng. Chem. 23 (5): 482–498. डीओआइ:10.1021/ie50257a005.
- ↑ O Hromatka, H Ebner (1949). "Investigations on vinegar fermentation: Generator for vinegar fermentation and aeration procedures". Enzymologia. 13: 369.
- ↑ Jia Huey Sim, Azlina Harun Kamaruddin, Wei Sing Long and Ghasem Najafpour (2007). "Clostridium aceticum—A potential organism in catalyzing carbon monoxide to acetic acid: Application of response surface methodology". Enzyme and Microbial Technology. 40 (5): 1234–1243. डीओआइ:10.1016/j.enzmictec.2006.09.017.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
बाह्य लिंक
| एसिटिक अम्ल से संबंधित मीडिया विकिमीडिया कॉमंस पर उपलब्ध है। |
- अन्तर्राष्ट्रीय रसायन सुरक्षा कार्ड 0363
- National Pollutant Inventory - Acetic acid fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- Method for sampling and analysis
- 29 CFR 1910.1000, Table Z-1 (US अनुमत जोखिम सीमा)
- ChemSub Online: CAS Number 64-19-7, Acetic acid
- Organic Syntheses में एसिटिक एसिड का उपयोग
- एसिटिक एसिड और pH अनुमापन - freeware for data analysis, simulation and distribution diagram generation
- एसिटिक एसिड की vapor pressure, liquid density, dynamic liquid viscosity, surface tension की परिकल्पना