पोटैशियम
| पोटैशियम / Potassium रासायनिक तत्व | |
 | |
| रासायनिक चिन्ह: | K |
| परमाणु संख्या: | 19 |
| रासायनिक शृंखला: | क्षार धातु |
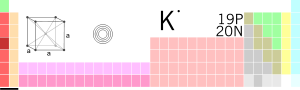 आवर्त सारणी में स्थिति
| |
 | |
| अन्य भाषाओं में नाम: | Potassium (अंग्रेज़ी), Калий (रूसी), દહાતુ (गुजराती), पलाश (मराठी), カリウム (जापानी) |

पोटैशियम (Potassium) एक रासायनिक तत्व है। इसका प्रतीक 'K' है। यह आर्वत सारणी के प्रथम मुख्य समूह का तत्व है। इसके दो स्थिर समस्थानिक (द्रव्यमान संख्या ३९ और ४१) ज्ञात हैं। एक अस्थिर समस्थानिक (द्रव्यमान संख्या ४०) प्रकृति में न्यून मात्रा में पाया जाता है। इनके अतिरिक्त तीन अन्य समस्थानिक (द्रव्यमान संख्या ३८, ४२ और ४३) कृत्रिम रूप से निर्मित हुए हैं। इसका नामकरण अंग्रेजी के pot ash से हुआ है, क्योंकि बहुत सारी पेड़-पौधों की राख को पानी से भरे घड़े में मिलाकर पोटैशियम का उत्पादन किया जाता था। लैटिन भाषा में इसके लिए शब्द है kailium (कैलियम)। Pot ash का संस्कृत-मूलक अनुवाद किया जाए तो पोटैशियम को उखाभस्मज कहा जा सकता है, अर्थात् जो उखा यानी मटके या घड़े की राख से यानी भस्म से उत्पन्न हो।
इतिहास
[संपादित करें]पोटैशियम के यौगिक पुरातन काल से ज्ञात हैं। चरकसंहिता में भस्म से क्षार बनाने की विधि का वर्णन आया है। चीनी तुर्किस्तान मे स्थित बुद्धमंदिर में एक चिकित्सा ग्रंथ की १८९० ई. में प्राप्ति हुई। इस ग्रंथ में यवक्षार (potassium carbonate) का वर्णन आया है। उपर्युक्त बातों से ज्ञात होता है कि पौटैशियम क्षारों का उपयोग पुरातन काल में ओषधि तथा रासायनिक क्रियाओं में होता था।
पोटैशियम तत्व का पृथक्करण १८०७ ई. में सर हंफ्री डेवी ने पोटैशियम हाइड्रॉक्साइड के विद्युद्विश्लैषण द्वारा किया। पोटाश शब्द के आधार पर डेवी ने इस तत्व का नाम पोटैशियम रखा।
उपस्थिति
[संपादित करें]पोटैशियम अत्यंत सक्रिय तत्व होने के कारण यौगिक अवस्था में ही पाया जाता है। इसके यौगिक पृथ्वी में समुचित मात्रा में फैले हैं। अनेक चट्टानों में इसके जटिल सिलिकेट उपस्थित रहते हैं। भूपर्पटी में २.६ प्रतिशत पोटैशियम रहता है। समुद्र में इस तत्व के यौगिकों का प्रचुर परिमाण है, परंतु प्रतिशत मात्रा में कम होने के कारण अभी उसका अधिक उपयोग नहीं हो पाया। जर्मनी में स्ट्रैसफुर्ट (Strassfurt) प्रदेश में इसके बहुत समृद्ध स्रोत हैं, जिनमें पोटैशियम क्लोराइड या सिलवाइट (sylvite) बड़ी मात्रा में मैग्नीशियम और कैल्सियम लवणों के साथ मिश्रित दशा में पाया जाता है। संयुक्त राज्य अमरीका, के कैलोफॉनिया प्रदेश में पोटैशियम के लवण पाए जाते हैं। भारत में शोरा (saltpetre), केनाइट (kanite, KCl, MgSO4, 3H2O) और लैंगबीनाइट (langbenie, K2SO4, 2MgSO4) पोटैशियम के मुख्य प्राप्य यौगिक है। ये सांभर झील में समुचित मात्रा में मिलते हैं।
निर्माण
[संपादित करें]पोटैशियम धातु का निर्माण डेवी की विधि पर निर्भर है। इसमें विशुद्ध पोटैशियम हाइड्रॉक्साइड अथवा कॉस्टिक पोटाश (KOH) का संगलित अवस्था में विद्युद्विश्लेषण करने पर, पोटैशियम लौह के ऋण विद्युदग्र पर जमा हो जाता है। कॉस्टिक पोटाश के स्थान पर पोटैशियम क्लोराइड (KCl) और पोटैशियम फ्लोराइड (KF) का संमिश्रण भी लिया जाता है।
गुण धर्म
[संपादित करें]
पोटैशियम नीलिमा लिए चमकदार श्वेत धातु है, जो ०० सें. ताप पर कठोर और भंगुर है, परंतु साधारण ताप पर इतना कोमल होता है कि चाकू से काटा जा सकता है। इसके कुछ भौतिक गुण निम्नांकित हैं : संकेत K, परमाणुसंख्या १९, परमाणुभार ३९.१०२, गलनांक ६२.५० सें., क्वथनांक ७६०० सें. घनत्व ०.८६५, परमाणुव्यास ४.७६ ऐंग्स्ट्रम, विद्युतप्रतिरोधकता ६.१५ माइक्रोओहम-मेंमी. तथा आयनीकरण विभव ४.३२९ इवो. है।
पोटैशियम वायु में शीघ्र मलिन हो जाता है और गर्म करने पर पिद्यलकर जलता है। जल में डालने पर विस्फोट के साथ क्रिया करके बैंगनी ज्वाला के साथ जलता है। इस प्रक्रिया में हाइड्रोजन मुक्त होता है, जो उच्च ताप के कारण वायु के संपर्क में जलने लगता है। पोटैशियम के वाष्प के कारण ज्वाला रंग बैंगनी हो जाता है। पोटैशियम को तेल अथवा निष्क्रिय वातावरण में सुरक्षित रखते हैं।
सोडियम की भाँति पोटैशियम भी द्रव ऐमोनिया में घुलकर नीला विलयन देता है और पोटैशमाइड (potassamide, KNH2) बनता है। २००० सें. से ४००० सें. ताप पर पोटैशियम हाइड्रोजन को अपने अंदर अधिधारित कर लेता है। ऐसा अनुमान है कि इस दशा में एक यौगिक (ख़्क्त) बनता है।
यौगिक
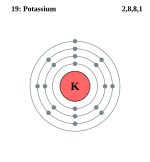
[संपादित करें]पोटैशियम एकसंयोजी यौगिक बनाता है। पोटैशियम परमाणु में चौथे कक्ष में केवल एक इलेक्ट्रान होता है। यदि यह इलेक्ट्रान परमाणु से निकल जाय, तो उसकी इलेक्ट्रान रचना आग्रन गैस के समान रह जायगी, जो स्थिर होती है। इस कारण प्रत्येक क्रिया में पोटैशियम की इस इलेक्ट्रॉन को प्रदान करने की प्रवृत्ति रहती है।
पोटैशियम के ऑक्साइड
[संपादित करें]पोटैशियम के निश्चित रूप से तीन ऑक्साइड, पोटैशियम ऑक्साइड (K2O), पोटैशियम डाइऑक्साइड (KO2) और पोटैशियम परऑक्साइड (K2O2), ज्ञात हैं। यदि पौटैशियम नाइट्राइड को पोटैशियम धातु के साथ वायु की अनुपस्थिति में गर्म किया जाय, तो पोटैशियम ऑक्साइड प्राप्त होगा, जो मटमैला भंगुर पदार्थ है। यह बड़ा सक्रिय ऑक्साइड है और तीव्र गति से जल से अभिक्रिया कर पोटैशियम हाइड्रॉक्साइड बनाता है।
यदि पोटैशियम को अधिक ऑक्सीजन के वातावरण में जलाया जाय, तो नारंगी रंग का ठोस पोटैशियम डाऑक्साइड बनता है। यह अत्यंत सक्रिय यौगिक है और जल से क्रिया कर ऑक्सीजन तथा हाइड्रोजन परऑक्साइड दोनों मुक्त करता है। यह अनेक तत्वों का ऑक्सीकरण तीव्र गति से करता है।
यदि पोटैशियम को ऑक्सीजन की परिगणित मात्रा में गर्म किया जाय, तो पोटैशियम परऑक्साइड प्राप्त होगा, जो श्वेत रंग का ठोस पदार्थ है। यह जल से प्रक्रिया कर केवल हाइड्रोजन पर ऑक्साइड मुक्त करता है।
कॉस्टिक पोटाश
[संपादित करें]यह पोटैशियम क्लोराइड विलयन के वैद्युत् विघटन से बनता है। इदस क्रिया को केसनर-कैलनर विधि कहते हैं। यह श्वेत, अपारदर्शी, ठोस पदार्थ है और गरम करने पर शीघ्र ही गल जाता है। यह अत्यंत जलप्रिय तथा अत्यंत जल विलेय है। अम्लों से क्रिया कर यह विलेय लवण बनाता है।
पोटैशियम के हैलौजन यौगिक
[संपादित करें]फ्लोरीन, क्लोरीन, ब्रोमीन तथा आयोडीन के साथ पोटैशियम के यौगिक ज्ञात हैं। कॉस्टिक पोटाश पर हाइड्रोफ्लोरिक अम्ल (HF) की क्रिया से पोटैशियम फ्लोराइड, एक सामान्य फ्लोराइड (KF), दूसरा अम्लीय फ्लोराइड (KHF2) बनते हैं। पोटैशियम फ्लोराइड नमकीन स्वादवाला आर्द्रताग्राही ठोस पदार्थ है।
पोटैशियम क्लोराइड जर्मनी के स्ट्रैसफुर्ट प्रदेश में बहुत मात्रा में उपलब्ध है। मैग्नीशियम और कैल्सियम यौगिकों के साथ मिश्रित अवस्था में यह प्राय: मिलता है। यदि इसके विलयन में हाइड्रोजन क्लोराइड गैस प्रवाहित की जाय, तो शुद्ध पोटैशियम क्लोराइड का अवक्षेप प्राप्त होगा और अन्य यौगिक विलयित अवस्था में रहेंगे। पोटैशियम क्लोराइड उर्वरक तथा अन्य पोटैशियम लवणों के बनाने के उद्योग में बड़ी मात्रा में काम आता है।
पोटैशियम ब्रोमाइड (KBr) और आयोडाइड (KI) कॉस्टिक पोटाश पर क्रमश: ब्रोमीन और आयोडीन की अभिक्रिया द्वारा प्राप्त हो सकते हैं। ये दोनों लवण क्लोराइड से समानता रखते हैं, परंतु जल में उससे अधिक विलेय हैं। पोटैशियम ब्रोमाइड का फोटोग्राफी उद्योग में उपयोग होता है। दोनों यौगिक ओषधि के रूप में तथा रासायनिक प्रयोगशालाओं की अनेक क्रियाओं में काम आते हैं।
पोटैशियम के गंधक यौगिक
[संपादित करें]गंधक के साथ पोटैशियम सल्फाइड और इसका जल के ५ अणुओं से संयुक्त हो (K2S, 5H2O) क्रिस्टल बनता है। इसके अतिरिक्त कॉस्टिक पोटाश के विलयन में हाइड्रोजन सल्फाइड प्रवाहित करने से पोटैशियम हाइड्रोसल्फाइड (KHS) बनता है। कॉस्टिक पोटाश विलयन में सलफर डाइआक्साइड (SO2) प्रवाहित करने पर पर पोटैशियम सल्फाइट (K2SO3) बनेगा।
पोटैशियम सल्फेट (K2SO4) स्ट्रैसफुर्ट के खनिजों में उपलब्ध है। यह अनेक रासायनिक उद्योगों में उपजात के रूप में भी मिलता है। इसका अम्लीय रूप पोटैशियम हाइड्रोजन सल्फेट (KHSO4) है। पोटैशियम सल्फेट का उपयोग ओषधियों, उर्वरक और फिटकरी के बनाने में प्राय: होता है।
पोटैशियम नाइट्रेट
[संपादित करें]कीमियागर इसे साल्टपीटर के नाम से संबोधित करते थे। प्रकृति में कार्बनिक पदार्थो के क्षय द्वारा यह बनता रहता है। बिहार में नोनी मिट्टी से यह निकाला जाता था। राजस्थान में साँभर झील के प्रदेश में भी उपलब्ध है।
पोटैशियम कार्बोनेट
[संपादित करें]इसे पोटाश भी कहते हैं। बहुत काल तक यह काष्ठराख से प्राप्त किया जाता था, जिसको संस्कृत ग्रंथों में यवक्षार कहा गया है। आजकल लेब्लांक विधि से यह तैयार होता है। यह जल में बहुत विलेय है और क्षार गुण प्रधान है। यह कठोर काँच, पोटाश साबुन और कॉस्टिक पोटाश बनाने में काम आता है। इसके विलयन में कार्बन डाइऑक्साइड प्रवाहित करने से पोटैशियम बाइकार्बोनेट (KHCO3) बनता है।
पोटैशियम के अविलेय यौगिक
[संपादित करें]पोटैशियम क्लोरोप्लैटिनेट (K2PtCl6) की विलेयता बहुत कम है। इसका पीला अवक्षेप पोटैशियम विश्लेषण में काम आता है। इसके अतिरिक्त पोटैशियम कोबाल्टीनाइट्राइट, K3, Co(NO2)6] भी अविलेय है, जो पोटैशियम और कोबाल्ट के विश्लेषण में प्रयुक्त होता है।
उपयोग
[संपादित करें]भोजन में
[संपादित करें]पोटैशियम क्लोराइड (KCl) का प्रयोग साधारण नमक (NaCl) के स्थान पर किया जाता है।
उद्योगों में
[संपादित करें]-
पोटैशियम फिल्डस्पार
-
Manganistan draselný - KMnO4


