एल्कलॉएड


एल्कलॉएड प्राकृतिक रूप से उपलब्ध रासायनिक यौगिक होते हैं, जिनमें प्रायः क्षारीय नाइट्रोजन परमाणु होते हैं। इस समूह में कुछ ऐसे बन्धु यौगिक भी आते हैं, जिनमें उदासीन[2] एवं अशक्त अम्लीय गुण होते हैं।[3] समान गुणों और संरचना वाले कुछ अन्य यौगिकों को भी एल्कलॉएड समूह में रखा जाता है।[4] कार्बन, हाइड्रोजन एवं नाइट्रोजन, अणुओं के अलावा एल्कलॉएड यौगिकों में गंधक और कभी-कभार क्लोरीन, ब्रोमीन या फॉस्फोरस भी उपस्थित हो सकते हैं।[5]
परिचय[संपादित करें]
'ऐलकालाँयड' (Alkaloid) शब्द का प्रयोग प्रारंभ से ही नाइट्रोजन वाले कार्बनिक क्षारीय यौगिकों के लिए किया गया था, क्योंकि उनके गुण क्षारों से मिलते-जुलते है का प्रयोग वनस्पतियों तथा प्राणिजगत् में पाए जानेवाले जटिल-कार्बनिक-क्र्कय दृष्टि से सक्रिय होते हैं। साधारण ऐमिन, ऐमिनो अम्ल तथा इस समुदाय में नहीं आते। ऐलकालायडों महत्व है। अनेक वनस्पतियों के निचोड़, जो ऐलकालायड हैं, ओषधियों के रूप में आदिकाल से प्रयुक्त होते रहे हैं और इनमें से कुछ का प्रयप में भी होता रहा है।
[चाचार्फीम]] के निचोड़ को पानी से तनु करके एक मणिभीय (crystaline) पदार्थ प्राप्त किया, जिसको पृथक करने तथा शुद्ध करने पर एक यौगिक मिला जो संभवत: पहला ऐलकालॉयड नारकोटीन था। क्षारीय विलयन के प्रयोग से उसने इस प बढ़ाने का प्रयत्न किया, किंतु इस प्रयास में उसे एक दूसरा ऐलकालॉयड प्राप्त हुआ, जो मारफ़ीन था। लगभग उसी समय ए. ऐगियम ने भी इसी विधि से मारफीन बनाया। परंतु किसी विशेष ऐलक में प्राप्त करके उसके गुणधर्मों को ठीक से प्रस्तुत करने का श्रेय एफ़.डब्ल्यू. ए. सर्टुनर्र को है। उसने सन् 1816 ई. में एक नवीन कार्बनिक लवण बनानेव प्राप्ति की जिससे उसने अनेक लवण बनाए और उसकी पोषकीय अभिक्रिया भी प्रदर्शित की। इसी बीच सन् 1810 ई. में बी.ए. गोम्स ने सिनकोना के ऐलकोहलीय निचोड़ पर क्षारीय विलयन से अभिक्रिया करके एक अवक्षेप प्राप् द्वारा मणिभीकृत करके सिनकोनीन प्राप्त किया। सन् 1817 ई. तथा 1840 ई. के मध्य प्राय: समस्त महत्वपूर्से वेरट्रीन, , पा, कोडीन आदि प्राप्त कर लिए गए।
अधिकांश ऐलकालायडों के नाम उन वनस्पतियों के आधार पर रखे गए हैं जिनसे वे प्राप्त किए जाते हैं। कुछ के नाम उनके द्वारा होनेवाले पोषकीय प्रभावों के अनुसार रखे गए हैं, जैसे मारफ़ीन का नाम स्वप्नों के ग्रीक देवता मारफ़िअस के आधार पर रखा गया है। कुछ के नाम प्रसिद्ध रसायनज्ञों के नाम पर रखे गए, जैसे पेलीटरीन का नाम फ्रांसीसी रसायनज्ञ पेलीटियर के नाम पर रखा गया है। ऐलकालॉयड वनस्पतियों के विभिन्न भागों में, जैसे पत्ती, छाल, जड़, आदि में, पाए जाते हैं। ये क्षारीय होते हैं, अत: इनमें से अधिकांश कुछ कार्बनिक अम्लों, जैसे औक्सैलिक, सक्सीनिक, साइट्रिक, मैलिक टैनिक आदि के साथ लवण रूप में पाए जाते हैं।
साधारणतया ऐलकालॉयड मणिभीय रूप में होते हैं और इनमें कार्बन, हाइड्रोजन, आक्सीजन तथा नाइट्रोजन तत्व पाए जाते हैं। परंतु निकोटीन तथा कोनीन जैसे कुछ ऐलकालॉयडों में आक्सिजन नहीं होता और वे अधिकतर द्रव रूप में रहते हैं। ऐलकालॉयडों में नाइट्रोजनवाले विषमचक्रीय कुछ यौगिक, जैसे पिरीडीन, पायरोल, क्वीनोलीन, आइसोक्वीन हैं और अन्य मूलक तत्व या कार्बन शृंखलाएँ इनके साथ संयुक्त रहती हैं। ये जल में अधिकतर अविलेय होते है, परंतु ऐलकोहेल, ईथर या क्लोरोफ़ार्म में विलेय होते हैं। अधिकांश ऐलकालॉयड प्रकाशसक्रिय होते हैं। ये कार्बनिक तथा अकार्बनिक अम्लों के साथ लवण बनाते हैं। प्राय: अधिक मात्रा में ऐलकालॉयडों का प्रभाव हानिकारक होता है, परंतु कम मात्रा में वे ओषधियों के रूप में प्रयुक्त होते हैं। इनका स्वाद कड़वा होता है।
वनस्पतियों से ऐलकालॉयड निकालने के लिए उनको हाइड्रोक्लोरिक या सल्फ़्यूरिक अम्ल से, या अम्लीय ऐथिल ऐलकोहल के साथ पाचित किया जाता है। इस कार्य के लिए एक विशेष मिश्रण का भी प्रयोग होता है, जिसमें ईथर, एथिल ऐल्कोहल तथा अमोनिया निश्चित मात्रा में मिले रहते हैं। इस मिश्रण को 'प्रोलियस द्रव' (प्रोलियस फ़्लुइड) कहते हैं।
कुछ अभिकर्मकों के साथ ऐलकालॉयड एक विशेष प्रकार का रंग या अवक्षेप बनाते हैं, जिनके द्वारा ये पहचाने जा सकते हैं। इनमें से प्रमुख ये हैं :
एर्डमान का अभिकर्मक – सांद्र सल्फ़यूरिक अम्ल जिसमें कुछ नाइट्रिक अम्ल मिला होता है;
फ़ोयड् अभिकर्मक – सांद्र सल्फ़्यूरिक अम्ल में अमोनियम मालिब्डेट का 1ऽ विलयन; सांद्र सल्फ़्यूरिक अम्ल में सोडियम मेटावेनेडेट का विलयन;
मेयर अभिकर्मक – मरकयूरिक का पोटैसियम आयोडाइड में विलयन;
वैगनर अभिकर्मक – आयोडीन का पोटैसियम आयोडाइड में विलयन
डेगंड्राफ अभिकर्मक – पोटैसियम-बिसमथ-आयोडाइड का विलयन; तथा
साइबलर अभिकर्मक – क्लोरोप्लैटिनिक, क्लोरो ऑरिक, फ़ासफ़ोटंग्स्टिक या सिलिको-टंग्स्टिक अम्ल का विलयन।
वर्गीकरण[संपादित करें]
नीचे की सारणी में मोनोमेरिक अल्कलॉयड की मुख्य श्रेणीयों के प्रमुख विवरण दिये गये हैं-
| Class | प्रमुख समूह | संश्लेषण के प्रमुख चरण | उदाहरण |
|---|---|---|---|
| Alkaloids with nitrogen heterocycles (true alkaloids) | |||
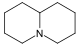
Pyrrolidine derivatives[6]
 |
Ornithine or arginine → putrescine → N-methylputrescine → N-methyl-Δ1-pyrroline [7] | Cuscohygrine, hygrine, hygroline, stachydrine[6][8] | |
Tropane derivatives[9]
 |
Atropine group Substitution in positions 3, 6 or 7 |
Ornithine or arginine → putrescine → N-methylputrescine → N-methyl-Δ1-pyrroline [7] | Atropine, scopolamine, hyoscyamine[6][9][10] |
| Cocaine group Substitution in positions 2 and 3 |
Cocaine, ecgonine [9][11] | ||
Pyrrolizidine derivatives[12]
 |
Non-esters | In plants: ornithine or arginine → putrescine → homospermidine → retronecine [7] | Retronecine, heliotridine, laburnine [12][13] |
| Complex esters of monocarboxylic acids | Indicine, lindelophin, sarracine [12] | ||
| Macrocyclic diesters | Platyphylline, trichodesmine[12] | ||
| 1-aminopyrrolizidines (lolines) | In fungi: L-proline + L-homoserine → N-(3-amino-3-carboxypropyl)proline → norloline[14][15] | Loline, N-formylloline, N-acetylloline[16] | |
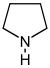
Piperidine derivatives[17]
 |
Lysine → cadaverine → Δ1-piperideine [18] | Sedamine, lobeline, anaferine, piperine [19][20] | |
| Octanoic acid → coniceine → coniine [21] | Coniine, coniceine [21] | ||
| Quinolizidine derivatives[22][23]
|
Lupinine group | Lysine → cadaverine → Δ1-piperideine [24] | Lupinine, nupharidin [22] |
| Cytisine group | Cytisine [22] | ||
| Sparteine group | Sparteine, lupanine, anahygrine[22] | ||
| Matrine group | Matrine, oxymatrine, allomatridine[22][25][26] | ||
| Ormosanine group | Ormosanine, piptantine[22][27] | ||
Indolizidine derivatives[28]
 |
Lysine → δ-semialdehyde of α-aminoadipic acid → pipecolic acid → 1 indolizidinone [29] | Swainsonine, castanospermine [30] | |
Pyridine derivatives[31][32]
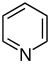 |
Simple derivatives of pyridine | Nicotinic acid → dihydronicotinic acid → 1,2-dihydropyridine [33] | Trigonelline, ricinine, arecoline [31][34] |
| Polycyclic noncondensing pyridine derivatives | Nicotine, nornicotine, anabasine, anatabine [31][34] | ||
| Polycyclic condensed pyridine derivatives | Actinidine, gentianine, pediculinine [35] | ||
| Sesquiterpene pyridine derivatives | Nicotinic acid, isoleucine [36] | Evonine, hippocrateine, triptonine [32][33] | |
Isoquinoline derivatives and related alkaloids [37]
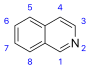 |
Simple derivatives of isoquinoline [38] | Tyrosine or phenylalanine → dopamine or tyramine (for alkaloids Amarillis) [39][40] | Salsoline, lophocerine [37][38] |
| Derivatives of 1- and 3-isoquinolines [41] | N-methylcoridaldine, noroxyhydrastinine [41] | ||
| Derivatives of 1- and 4-phenyltetrahydroisoquinolines [38] | Cryptostilin [38][42] | ||
| Derivatives of 5-naftil-isoquinoline [43] | Ancistrocladine [43] | ||
| Derivatives of 1- and 2-benzyl-izoquinolines [44] | Papaverine, laudanosine, sendaverine | ||
| Cularine group[45] | Cularine, yagonine [45] | ||
| Pavines and isopavines [46] | Argemonine, amurensine [46] | ||
| Benzopyrrocolines [47] | Cryptaustoline [38] | ||
| Protoberberines [38] | Berberine, canadine, ophiocarpine, mecambridine, corydaline [48] | ||
| Phthalidisoquinolines [38] | Hydrastine, narcotine (Noscapine) [49] | ||
| Spirobenzylisoquinolines [38] | Fumaricine [46] | ||
| Ipecacuanha alkaloids[50] | Emetine, protoemetine, ipecoside [50] | ||
| Benzophenanthridines [38] | Sanguinarine, oxynitidine, corynoloxine [51] | ||
| Aporphines [38] | Glaucine, coridine, liriodenine [52] | ||
| Proaporphines [38] | Pronuciferine, glaziovine [38][47] | ||
| Homoaporphines [53] | Kreysiginine, multifloramine [53] | ||
| Homoproaporphines [53] | Bulbocodine [45] | ||
| Morphines[54] | Morphine, codeine, thebaine, sinomenine [55] | ||
| Homomorphines [56] | Kreysiginine, androcymbine [54] | ||
| Tropoloisoquinolines [38] | Imerubrine [38] | ||
| Azofluoranthenes [38] | Rufescine, imeluteine [57] | ||
| Amaryllis alkaloids[58] | Lycorine, ambelline, tazettine, galantamine, montanine [59] | ||
| Erythrina alkaloids[42] | Erysodine, erythroidine [42] | ||
| Phenanthrene derivatives [38] | Atherosperminine [38][48] | ||
| Protopines [38] | Protopine, oxomuramine, corycavidine [51] | ||
| Aristolactam [38] | Doriflavin [38] | ||
Oxazole derivatives[60]
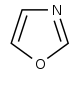 |
Tyrosine → tyramine [61] | Annuloline, halfordinol, texaline, texamine[62] | |
Isoxazole derivatives
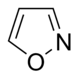 |
Ibotenic acid → Muscimol | Ibotenic acid, Muscimol | |
Thiazole derivatives[63]
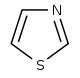 |
1-Deoxy-D-xylulose 5-phosphate (DOXP), tyrosine, cysteine [64] | Nostocyclamide, thiostreptone [63][65] | |
Quinazoline derivatives[66]
 |
3,4-Dihydro-4-quinazolone derivatives | Anthranilic acid or phenylalanine or ornithine [67] | Febrifugine[68] |
| 1,4-Dihydro-4-quinazolone derivatives | Glycorine, arborine, glycosminine[68] | ||
| Pyrrolidine and piperidine quinazoline derivatives | Vazicine (peganine) [60] | ||
| Acridine derivatives[60]
|
Anthranilic acid [69] | Rutacridone, acronicine[70][71] | |
Quinoline derivatives[72][73]
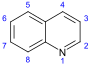 |
Simple derivatives of quinoline derivatives of 2 – quinolones and 4-quinolone | Anthranilic acid → 3-carboxyquinoline [74] | Cusparine, echinopsine, evocarpine[73][75][76] |
| Tricyclic terpenoids | Flindersine[73][77] | ||
| Furanoquinoline derivatives | Dictamnine, fagarine, skimmianine[73][78][79] | ||
| Quinines | Tryptophan → tryptamine → strictosidine (with secologanin) → korinanteal → cinhoninon [40][74] | Quinine, quinidine, cinchonine, cinhonidine [77] | |
Indole derivatives[55]
 |
Non-isoprene indole alkaloids | ||
| Simple indole derivatives [80] | Tryptophan → tryptamine or 5-hydroxitriptofan [81] | Serotonin, psilocybin, dimethyltryptamine (DMT), bufotenin [82][83] | |
| Simple derivatives of β-carboline [84] | Harman, harmine, harmaline, eleagnine [80] | ||
| Pyrroloindole alkaloids [85] | Physostigmine (eserine), etheramine, physovenine, eptastigmine[85] | ||
| Semiterpenoid indole alkaloids | |||
| Ergot alkaloids[55] | Tryptophan → chanoclavine → agroclavine → elimoclavine → paspalic acid → lysergic acid [85] | Ergotamine, ergobasine, ergosine[86] | |
| Monoterpenoid indole alkaloids | |||
| Corynanthe type alkaloids[81] | Tryptophan → tryptamine → strictosidine (with secologanin) [81] | Ajmalicine, sarpagine, vobasine, ajmaline, yohimbine, reserpine, mitragynine,[87][88] group strychnine and (Strychnine brucine, aquamicine, vomicine [89]) | |
| Iboga-type alkaloids[81] | Ibogamine, ibogaine, voacangine[81] | ||
| Aspidosperma-type alkaloids[81] | Vincamine, vinca alkaloids, vincotine, aspidospermine[90][91] | ||
Imidazole derivatives[60]
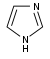 |
Directly from histidine[92] | Histamine, pilocarpine, pilosine, stevensine[60][92] | |
Purine derivatives[93]
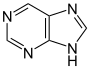 |
Xanthosine (formed in purine biosynthesis) → 7 methylxantosine → 7-methyl xanthine → theobromine → caffeine [40] | Caffeine, theobromine, theophylline, saxitoxin [94][95] | |
| Alkaloids with nitrogen in the side chain (protoalkaloids) | |||
β-Phenylethylamine derivatives[47]
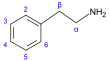 |
Tyrosine or phenylalanine → dioxyphenilalanine → dopamine → adrenaline and mescaline tyrosine → tyramine phenylalanine → 1-phenylpropane-1,2-dione → cathinone → ephedrine and pseudoephedrine [36][96][97] | Tyramine, ephedrine, pseudoephedrine, mescaline, cathinone, catecholamines (adrenaline, noradrenaline, dopamine)[36][98] | |
Colchicine alkaloids [99]
 |
Tyrosine or phenylalanine → dopamine → autumnaline → colchicine [100] | Colchicine, colchamine[99] | |
Muscarine [101]
 |
Glutamic acid → 3-ketoglutamic acid → muscarine (with pyruvic acid)[102] | Muscarine, allomuscarine, epimuscarine, epiallomuscarine[101] | |
Benzylamine[103]
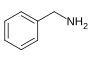 |
Phenylalanine with valine, leucine or isoleucine[104] | Capsaicin, dihydrocapsaicin, nordihydrocapsaicin, vanillylamine[103][105] | |
| Polyamines alkaloids | |||
| Putrescine derivatives[106]
|
ornithine → putrescine → spermidine → spermine[107] | Paucine [106] | |
| Spermidine derivatives[106]
|
Lunarine, codonocarpine[106] | ||
| Spermine derivatives[106]
|
Verbascenine, aphelandrine [106] | ||
| Peptide (cyclopeptide) alkaloids | |||
| Peptide alkaloids with a 13-membered cycle [108][109] | Nummularine C type | From different amino acids [108] | Nummularine C, Nummularine S [108] |
| Ziziphine type | Ziziphine A, sativanine H [108] | ||
| Peptide alkaloids with a 14-membered cycle [108][109] | Frangulanine type | Frangulanine, scutianine J [109] | |
| Scutianine A type | Scutianine A [108] | ||
| Integerrine type | Integerrine, discarine D [109] | ||
| Amphibine F type | Amphibine F, spinanine A [108] | ||
| Amfibine B type | Amphibine B, lotusine C [108] | ||
| Peptide alkaloids with a 15-membered cycle [109] | Mucronine A type | Mucronine A [110][109] | |
| Pseudoalkaloids (terpenes and steroids) | |||
Diterpenes [110]
 |
Lycoctonine type | Mevalonic acid → izopentenilpyrophosfate → geranyl pyrophosphate [111][112] | Aconitine, delphinine [110][113] |
Steroids[114]
 |
Cholesterol, arginine[115] | Solasodine, solanidine, veralkamine, batrachotoxin[116] | |
सन्दर्भ[संपादित करें]
- ↑ Andreas Luch (2009). Molecular, clinical and environmental toxicology. Springer. पृ॰ 20. आई॰ऍस॰बी॰ऍन॰ 3764383356.
- ↑ IUPAC. Compendium of Chemical Terminology Archived 2010-02-12 at the वेबैक मशीन, 2nd ed. (The "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997) ISBN 0-9678550-9-8 doi:10.1351/goldbook
- ↑ R. H. F. Manske. The Alkaloids. Chemistry and Physiology. Volume VIII. - New York: Academic Press, 1965, p. 673
- ↑ Robert Alan Lewis. Lewis' dictionary of toxicology Archived 2013-06-05 at the वेबैक मशीन. CRC Press, 1998, p. 51 ISBN 1-56670-223-2
- ↑ "Chemical Encyclopedia: alkaloids". मूल से 14 जनवरी 2011 को पुरालेखित. अभिगमन तिथि 17 जुलाई 2010.
- ↑ अ आ इ Plemenkov, p. 224
- ↑ अ आ इ Aniszewski, p. 75
- ↑ Orekhov, p. 33
- ↑ अ आ इ Chemical Encyclopedia: Tropan alkaloids Archived 2016-10-24 at the वेबैक मशीन. xumuk.ru
- ↑ Hesse, p. 34
- ↑ Aniszewski, p. 27
- ↑ अ आ इ ई Chemical Encyclopedia: Pyrrolizidine alkaloids Archived 2016-09-17 at the वेबैक मशीन. xumuk.ru
- ↑ Plemenkov, p. 229
- ↑ Blankenship JD, Houseknecht JB, Pal S, Bush LP, Grossman RB, Schardl CL (2005). "Biosynthetic precursors of fungal pyrrolizidines, the loline alkaloids". Chembiochem. 6 (6): 1016–1022. PMID 15861432. डीओआइ:10.1002/cbic.200400327.
- ↑ Faulkner JR, Hussaini SR, Blankenship JD, Pal S, Branan BM, Grossman RB, Schardl CL (2006). "On the sequence of bond formation in loline alkaloid biosynthesis". Chembiochem. 7 (7): 1078–1088. PMID 16755627. डीओआइ:10.1002/cbic.200600066.
- ↑ Schardl CL, Grossman RB, Nagabhyru P, Faulkner JR, Mallik UP (2007). "Loline alkaloids: currencies of mutualism". Phytochemistry. 68 (7): 980–996. PMID 17346759. डीओआइ:10.1016/j.phytochem.2007.01.010.
- ↑ Plemenkov, p. 225
- ↑ Aniszewski, p. 95
- ↑ सन्दर्भ त्रुटि:
<ref>का गलत प्रयोग;ref24नाम के संदर्भ में जानकारी नहीं है। - ↑ Orekhov, p. 80
- ↑ अ आ सन्दर्भ त्रुटि:
<ref>का गलत प्रयोग;ref25नाम के संदर्भ में जानकारी नहीं है। - ↑ अ आ इ ई उ ऊ Chemical Encyclopedia: Quinolizidine alkaloids Archived 2016-10-24 at the वेबैक मशीन. xumuk.ru
- ↑ Saxton, Vol. 1, p. 93
- ↑ Aniszewski, p. 98
- ↑ Saxton, Vol. 1, p. 91
- ↑ Joseph P. Michael (2002). "Indolizidine and quinolizidine alkaloids". Nat. Prod. Rep. 19 (5): 458–475. डीओआइ:10.1039/b208137g.
- ↑ Saxton, Vol. 1, p. 92
- ↑ Dewick, p. 310
- ↑ Aniszewski, p. 96
- ↑ Aniszewski, p. 97
- ↑ अ आ इ Plemenkov, p. 227
- ↑ अ आ Chemical Encyclopedia: pyridine alkaloids Archived 2016-10-21 at the वेबैक मशीन. xumuk.ru
- ↑ अ आ Aniszewski, p. 107
- ↑ अ आ Aniszewski, p. 85
- ↑ Plemenkov, p. 228
- ↑ अ आ इ सन्दर्भ त्रुटि:
<ref>का गलत प्रयोग;Aniszewski 110नाम के संदर्भ में जानकारी नहीं है। - ↑ अ आ Hesse, p. 36
- ↑ अ आ इ ई उ ऊ ए ऐ ओ औ क ख ग घ ङ च छ ज झ ञ Chemical Encyclopedia: isoquinoline alkaloids Archived 2016-10-24 at the वेबैक मशीन. xumuk.ru
- ↑ Aniszewski, pp. 77–78
- ↑ अ आ इ Begley, Alkaloid Biosynthesis
- ↑ अ आ Saxton, Vol. 3, p. 122
- ↑ अ आ इ Hesse, p. 54
- ↑ अ आ Hesse, p. 37
- ↑ Hesse, p. 38
- ↑ अ आ इ Hesse, p. 46
- ↑ अ आ इ Hesse, p. 50
- ↑ अ आ इ Kenneth W. Bentley (1997). "β-Phenylethylamines and the isoquinoline alkaloids" (PDF). Nat. Prod. Rep. 14 (4): 387–411. PMID 9281839. डीओआइ:10.1039/NP9971400387. मूल से 13 अप्रैल 2014 को पुरालेखित (PDF). अभिगमन तिथि 25 सितंबर 2016.
- ↑ अ आ Hesse, p. 47
- ↑ Hesse, p. 39
- ↑ अ आ Hesse, p. 41
- ↑ अ आ Hesse, p. 49
- ↑ Hesse, p. 44
- ↑ अ आ इ Saxton, Vol. 3, p. 164
- ↑ अ आ Hesse, p. 51
- ↑ अ आ इ Plemenkov, p. 236
- ↑ Saxton, Vol. 3, p. 163
- ↑ Saxton, Vol. 3, p. 168
- ↑ Hesse, p. 52
- ↑ Hesse, p. 53
- ↑ अ आ इ ई उ Plemenkov, p. 241
- ↑ Brossi, Vol. 35, p. 261
- ↑ Brossi, Vol. 35, pp. 260–263
- ↑ अ आ Plemenkov, p. 242
- ↑ Begley, Cofactor Biosynthesis
- ↑ John R. Lewis (2000). "Amaryllidaceae, muscarine, imidazole, oxazole, thiazole and peptide alkaloids, and other miscellaneous alkaloids". Nat. Prod. Rep. 17 (1): 57–84. PMID 10714899. डीओआइ:10.1039/a809403i.
- ↑ Chemical Encyclopedia: Quinazoline alkaloids Archived 2016-10-24 at the वेबैक मशीन. xumuk.ru
- ↑ Aniszewski, p. 106
- ↑ अ आ Aniszewski, p. 105
- ↑ Richard B. Herbert; Herbert, Richard B.; Herbert, Richard B. (1999). "The biosynthesis of plant alkaloids and nitrogenous microbial metabolites". Nat. Prod. Rep. 16 (2): 199–208. डीओआइ:10.1039/a705734b.
- ↑ Plemenkov, pp. 231, 246
- ↑ Hesse, p. 58
- ↑ Plemenkov, p. 231
- ↑ अ आ इ ई Chemical Encyclopedia: Quinoline alkaloids Archived 2016-10-24 at the वेबैक मशीन. xumuk.ru
- ↑ अ आ Aniszewski, p. 114
- ↑ Orekhov, p. 205
- ↑ Hesse, p. 55
- ↑ अ आ Plemenkov, p. 232
- ↑ Orekhov, p. 212
- ↑ Aniszewski, p. 118
- ↑ अ आ Aniszewski, p. 112
- ↑ अ आ इ ई उ ऊ Aniszewski, p. 113
- ↑ Hesse, p. 15
- ↑ Saxton, Vol. 1, p. 467
- ↑ Dewick, pp. 349–350
- ↑ अ आ इ Aniszewski, p. 119
- ↑ Hesse, p. 29
- ↑ Hesse, pp. 23–26
- ↑ Saxton, Vol. 1, p. 169
- ↑ Saxton, Vol. 5, p. 210
- ↑ Hesse, pp. 17–18
- ↑ Dewick, p. 357
- ↑ अ आ Aniszewski, p. 104
- ↑ Hesse, p. 72
- ↑ Hesse, p. 73
- ↑ Dewick, p. 396
- ↑ सन्दर्भ त्रुटि:
<ref>का गलत प्रयोग;ref31नाम के संदर्भ में जानकारी नहीं है। - ↑ "PlantCyc Pathway: ephedrine biosynthesis". मूल से 10 दिसंबर 2011 को पुरालेखित. अभिगमन तिथि 25 सितंबर 2016.
- ↑ Hesse, p. 76
- ↑ अ आ Chemical Encyclopedia: colchicine alkaloids Archived 2016-10-24 at the वेबैक मशीन. xumuk.ru
- ↑ Aniszewski, p. 77
- ↑ अ आ Hesse, p. 81
- ↑ Brossi, Vol. 23, p. 376
- ↑ अ आ Hesse, p. 77
- ↑ Brossi, Vol. 23, p. 268
- ↑ Brossi, Vol. 23, p. 231
- ↑ अ आ इ ई उ ऊ Hesse, p. 82
- ↑ "Spermine Biosynthesis". मूल से 4 दिसंबर 2016 को पुरालेखित. अभिगमन तिथि 25 सितंबर 2016.
- ↑ अ आ इ ई उ ऊ ए ऐ सन्दर्भ त्रुटि:
<ref>का गलत प्रयोग;ref27नाम के संदर्भ में जानकारी नहीं है। - ↑ अ आ इ ई उ ऊ Plemenkov, p. 243
- ↑ अ आ इ सन्दर्भ त्रुटि:
<ref>का गलत प्रयोग;ref23नाम के संदर्भ में जानकारी नहीं है। - ↑ Chemical Encyclopedia: Terpenes Archived 2016-10-02 at the वेबैक मशीन. xumuk.ru
- ↑ Begley, Natural Products: An Overview
- ↑ Atta-ur-Rahman and M. Iqbal Choudhary (1997). "Diterpenoid and steroidal alkaloids". Nat. Prod. Rep. 14 (2): 191–203. PMID 9149410. डीओआइ:10.1039/np9971400191.
- ↑ Hesse, p. 88
- ↑ Dewick, p. 388
- ↑ Plemenkov, p. 247