परमाणु कक्षक

| यह लेख किसी और भाषा में लिखे लेख का खराब अनुवाद है। यह किसी ऐसे व्यक्ति द्वारा लिखा गया है जिसे हिन्दी अथवा स्रोत भाषा की सीमित जानकारी है। कृपया इस अनुवाद को सुधारें। मूल लेख "अन्य भाषाओं की सूची" में "{{{1}}}" में पाया जा सकता है। |
क्वांटम यांत्रिकी में, एक परमाणु कक्षीय एक गणितीय समारोह में कहा कि या तो एक इलेक्ट्रॉन या एक परमाणु में इलेक्ट्रॉनों की एक जोड़ी की तरंग की तरह व्यवहार का वर्णन करता है। इस समारोह में एक परमाणु के किसी भी इलेक्ट्रॉन पाने की संभावना की गणना करने के लिए इस्तेमाल किया जा सकता परमाणु के नाभिक के चारों ओर किसी भी विशिष्ट क्षेत्र में। अवधि , परमाणु कक्षीय , यह भी शारीरिक क्षेत्र या स्थान जहां इलेक्ट्रॉन , के रूप में कक्षीय की विशेष गणितीय रूप से परिभाषित उपस्थित होने के लिए गणना की जा सकती करने के लिए उल्लेख कर सकते हैं। एक परमाणु में प्रत्येक कक्षीय तीन क्वांटम संख्या n, ℓ , और मीटर के मूल्यों, जो क्रमशः इलेक्ट्रॉन की ऊर्जा , कोणीय गति , और एक कोणीय गति वेक्टर घटक ( चुंबकीय क्वांटम संख्या ) के अनुरूप की एक अद्वितीय सेट की विशेषता है। इस तरह प्रत्येक कक्षीय दो इलेक्ट्रॉनों के साथ अपने स्वयं के स्पिन क्वांटम संख्या प्रत्येक की एक अधिकतम द्वारा कब्जा किया जा सकता है। परमाणु कक्षाओं परमाणु कक्षीय मॉडल (वैकल्पिक रूप से बादल इलेक्ट्रॉन या तरंग यांत्रिकी मॉडल के रूप में जाना जाता है) , इस मामले में इलेक्ट्रॉनों की उपसूक्ष्म व्यवहार विसशवलयिसिग के लिए एक आधुनिक ढांचे की बुनियादी इमारत ब्लॉकों हैं। इस मॉडल में एक बहु इलेक्ट्रॉन परमाणु के इलेक्ट्रॉन बादल ( सन्निकटन में) का निर्माण किया जा रहा है एक इलेक्ट्रॉन विन्यास सरल हाइड्रोजन की तरह परमाणु कक्षाओं का एक उत्पाद है कि के रूप में देखा जा सकता है
इलेक्ट्रॉन गुण[संपादित करें]
क्वांटम यांत्रिकी और प्रयोगात्मक निष्कर्षों (जैसे इलेक्ट्रॉन की दो भट्ठा विवर्तन के रूप में) के विकास के साथ , यह पाया गया है कि एक नाभिक के चारों ओर परिक्रमा इलेक्ट्रॉनों को पूरी तरह से कणों के रूप में वर्णित नहीं किया जा सकता है, लेकिन लहर कण द्वंद्व से समझाया जा करने की जरूरत है। इस अर्थ में, इलेक्ट्रॉनों निम्नलिखित गुण होते हैं :
लहर की तरह गुण: 1. इलेक्ट्रॉनों एक ग्रह सूर्य की परिक्रमा के अर्थ में नाभिक के चारों ओर चक्कर नहीं है , लेकिन इसके बजाय खड़े तरंगों के रूप में मौजूद हैं। संभव सबसे कम ऊर्जा एक इलेक्ट्रॉन ले जा सकते हैं इसलिए एक तार पर एक लहर की मौलिक आवृत्ति के अनुरूप है। उच्च ऊर्जा राज्यों तो मौलिक आवृत्ति के लयबद्ध के समान हैं। 2. इलेक्ट्रॉनों हालांकि एक भी बिंदु पर इलेक्ट्रॉन के साथ बातचीत की संभावना इलेक्ट्रॉन की लहर समारोह से पाया जा सकता है , एक बिंदु स्थान में कभी नहीं रहे हैं।
कण- जैसे गुण: 1.वहाँ हमेशा नाभिक की परिक्रमा इलेक्ट्रॉनों के एक पूर्णांक संख्या है। 2.इलेक्ट्रॉनों एक कण की तरह फैशन में कक्षाओं के बीच कूद। उदाहरण के लिए, अगर एक फोटान इलेक्ट्रॉनों हमलों, केवल एक ही इलेक्ट्रॉन परिवर्तन फोटोन के जवाब में कहा गया है। 3.इलेक्ट्रॉनों को बनाए रखने जैसे कण - जैसे गुण: प्रत्येक लहर राज्य इलेक्ट्रॉन कण के रूप में ही बिजली के प्रभारी है। प्रत्येक लहर राज्य एक भी असतत स्पिन ( ऊपर स्पिन या स्पिन डाउन ) .यह अपने सूपरपोसिशन पर निर्भर कर सकता है।
इस प्रकार, सूर्य के चारों ओर घूमने ग्रहों के लिए स्पष्ट सादृश्य के बावजूद , इलेक्ट्रॉनों बस के रूप में ठोस कणों वर्णित नहीं किया जा सकता। इसके अलावा, परमाणु कक्षाओं बारीकी से साधारण परमाणुओं में एक ग्रह की अण्डाकार पथ समान नहीं है। एक और अधिक सटीक सादृश्य एक बड़े और अक्सर अजीब तरह से आकार "वातावरण " ( इलेक्ट्रॉन ), एक अपेक्षाकृत छोटे ग्रह के चारों ओर वितरित ( परमाणु नाभिक ) की है कि हो सकता है। परमाणु कक्षाओं वास्तव में इस " वातावरण" के आकार का वर्णन है जब केवल एक इलेक्ट्रॉन एक परमाणु में मौजूद है। अधिक इलेक्ट्रॉनों एक परमाणु को जोड़ रहे हैं, अतिरिक्त इलेक्ट्रॉनों अधिक समान रूप से नाभिक के चारों ओर अंतरिक्ष के एक मात्रा में भरने के लिए तो यह है कि जिसके परिणामस्वरूप संग्रह (कभी कभी परमाणु " इलेक्ट्रॉन बादल" करार दिया ) एक आम तौर पर गोलाकार क्षेत्र की ओर जाता है होते हैं संभावना का वर्णन करने के लिए जहां परमाणु इलेक्ट्रॉनों मिल जाएगा। अनिश्चितता प्रिंसिपल की वजह से है।
कक्षाओं के प्रकार[संपादित करें]
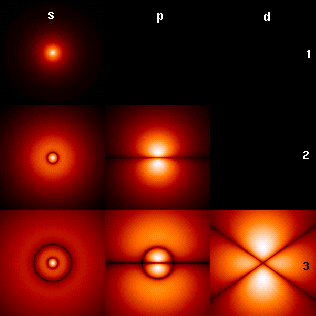
परमाणु कक्षाओं हाइड्रोजन की तरह " कक्षाओं " जो एक हाइड्रोजन की तरह " परमाणु" के लिए श्रोडिंगर समीकरण को सटीक समाधान कर रहे हैं हो सकता है (यानी , एक इलेक्ट्रॉन के साथ एक परमाणु )। वैकल्पिक रूप से, परमाणु कक्षाओं कार्य करता है कि एक इलेक्ट्रॉन (अर्थात् , कक्षाओं ) के समन्वय पर निर्भर करती है लेकिन लहर कार्य करता है कि एक परमाणु या अणु में सभी इलेक्ट्रॉनों का एक साथ निर्देशांक पर निर्भर अनुमान करने के लिए अंक शुरू करने के रूप में इस्तेमाल कर रहे हैं के लिए देखें। परमाणु कक्षाओं के लिए चुना समन्वय प्रणाली आम तौर पर गोलाकार निर्देशांक ( r, θ , φ ) परमाणुओं और अणुओं पोलिअटोमिक में कार्तीश्यन (x, y, z ) में। (परमाणुओं के लिए) गोलाकार निर्देशांक का लाभ एक कक्षीय लहर समारोह तीन कारकों प्रत्येक निर्भर का एक उत्पाद है उस पर एक भी समन्वय स्थापित है : ψ (r, θ , φ ) = R(r) Θ ( θ ) Φ ( φ )। परमाणु कक्षाओं के कोणीय कारकों Θ ( θ ) Φ ( φ ) उत्पन्न s, p , d, आदि गोलाकार लयबद्ध के वास्तविक संयोजन के रूप में कार्य Yℓm ( θ , φ ) ( जहां ℓ और एम क्वांटम संख्या रहे हैं )
इतिहास[संपादित करें]

शब्द " कक्षीय " एक इलेक्ट्रॉन कक्षीय लहर समारोह के लिए एक संक्षिप्त नाम के रूप में 1932 में रॉबर्ट मुल्लिक्कन द्वारा गढ़ा गया था। हालांकि, विचार है कि इलेक्ट्रॉनों निश्चित कोणीय गति के साथ एक कॉम्पैक्ट नाभिक के चारों ओर घूमना हो सकता है खांसने से कम से कम 19 साल पहले तर्क दिया गया था नील्स बोह्र द्वारा , और जापानी भौतिक विज्ञानी हनतारो नगओका इलेक्ट्रॉनिक व्यवहार के लिए एक कक्षा आधारित परिकल्पना प्रकाशित के रूप में जल्दी 1904 ये इलेक्ट्रॉन " कक्षाओं " के व्यवहार की व्याख्या के रूप में क्वांटम के विकास के पीछे ड्राइविंग बलों में से एक था यांत्रिकी।
शुरुआती मॉडल[संपादित करें]
जे जे के साथ 1897 में इलेक्ट्रॉन की थॉमसन की खोज , यह स्पष्ट हो गया है कि परमाणु प्रकृति के सबसे छोटे ब्लॉकों का निर्माण नहीं थे , बल्कि समग्र कणों थे। कई परीक्षा परमाणुओं के भीतर नई खोज की संरचना की कल्पना कैसे परमाणु घटक भागों एक दूसरे के साथ बातचीत हो सकती है। थॉमसन ने अनुमान लगाया है कि कई इलेक्ट्रॉनों एक सकारात्मक आरोप लगाया जेली जैसा पदार्थ के भीतर कक्षा - तरह के छल्ले में घूमती है, और इलेक्ट्रॉन की खोज और 1909 के बीच , इस " बेर का हलवा मॉडल" परमाणु संरचना का सबसे व्यापक रूप से स्वीकार विवरण था।
फौरन थॉमसन की खोज के बाद , हनताअरो नगओका इलेक्ट्रॉनिक संरचना के लिए एक अलग मॉडल की भविष्यवाणी की। बेर का हलवा मॉडल के विपरीत, नगओका के " सैटर्नियन मॉडल" में सकारात्मक चार्ज एक केंद्रीय कोर में केंद्रित था ,शनि के छल्ले की याद ताजा परिपत्र कक्षाओं में इलेक्ट्रॉनों खींच। कुछ लोगों को समय पर नगओका के काम का नोटिस लिया , और नगओका खुद भी अपनी अवधारणा पर सिद्धांत रूप में एक मौलिक दोष मान्यता प्राप्त है, अर्थात् है कि एक शास्त्रीय आरोप लगाया वस्तु है क्योंकि यह तेजी है कक्षीय गति को बनाए रखने के लिए नहीं कर सकते हैं और इसलिए विद्युत चुम्बकीय के कारण ऊर्जा खो देता है विकिरण। फिर भी, सैटर्नियन मॉडल निकला अपने समकालीनों की तुलना में किसी भी आधुनिक सिद्धांत के साथ आम में अधिक है।
कक्षीय नाम[संपादित करें]
कक्षाओं के रूप में नाम दिए गए हैं : "X प्रकार" जहां X ऊर्जा स्तर प्रिंसिपल क्वांटम संख्या के लिए इसी है n प्रकार एक कम मामले आकार या कक्षीय की सबशेल देनोतिं पत्र है और यह कोणीय क्वांटम संख्या ℓ से मेल खाती है , और y कि कक्षीय में इलेक्ट्रॉनों की संख्या है। उदाहरण के लिए, कक्षीय 1s2 (उच्चारण " एक ईएसएस दो" ) दो इलेक्ट्रॉनों है और सबसे कम ऊर्जा स्तर है (n= 1) और ℓ की एक कोणीय क्वांटम संख्या = 0। एक्स-रे के अंकन में, प्रिंसिपल क्वांटम संख्या है इसके साथ जुड़े एक पत्र दिया। = 1, 2 , 3, 4 , 5 के लिए , ..., उन लोगों की संख्या के साथ जुड़े पत्र कश्मीर,ℓ , m, n,o , ... क्रमशः रहे हैं।
हाइड्रोजन की तरह कक्षाओं[संपादित करें]
सरलतम परमाणु कक्षाओं उन है कि जैसे हाइड्रोजन परमाणु के रूप में एक इलेक्ट्रॉन के साथ सिस्टम , के लिए गणना कर रहे हैं। एक इलेक्ट्रॉन के लिए नीचे आयनित किसी भी अन्य तत्व के एक परमाणु बहुत हाइड्रोजन के समान है, और कक्षाओं में एक ही रूप ले लो। एक नकारात्मक और सकारात्मक एक कण की इस प्रणाली के लिए स्छ्रोदिङेर् समीकरण में, परमाणु कक्षाओं ऊर्जा के लिए हामिलटेनियन ऑपरेटर की एइगेन्स्तेतेस हैं। वे विश्लेषणात्मक प्राप्त किया जा सकता है, जिसका अर्थ है कि जिसके परिणामस्वरूप कक्षाओं बहुपद श्रृंखला के उत्पादों, और घातीय और त्रिकोणमितीय कार्य कर रहे हैं
दो या दो से अधिक इलेक्ट्रॉनों के साथ परमाणुओं के लिए, शासी समीकरण ही चलने का सन्निकटन के तरीकों के उपयोग के साथ हल किया जा सकता है। बहु इलेक्ट्रॉन परमाणुओं की कक्षाओं में गुणात्मक हाइड्रोजन के उन लोगों के लिए समान हैं, और सरल मॉडल में , वे एक ही फार्म के लिए लिया जाता है। और अधिक कठोर और सटीक विश्लेषण के लिए, संख्यात्मक अनुमानों इस्तेमाल किया जाना चाहिए।
रीयल कक्षाओं[संपादित करें]
एक परमाणु में एक क्रिस्टलीय ठोस कई वरीय कुल्हाड़ियों का मानना है एम्बेडेड है , लेकिन कोई पसंदीदा दिशा। रेडियल कार्य करता है और एक भी गोलाकार हार्मोनिक के उत्पाद के बाहर परमाणु कक्षाओं के निर्माण के बजाय, गोलाकार लयबद्ध के रैखिक संयोजन आम तौर पर इस्तेमाल कर रहे हैं के लिए बनाया गया है, ताकि गोलाकार harmonics के काल्पनिक हिस्सा रद्द करें। ये असली कक्षाओं इमारत ब्लॉकों सबसे अधिक कक्षीय दृश्यावलोकन में दिखाया जाता है।
वास्तविक हाइड्रोजन की तरह कक्षाओं में, उदाहरण के लिए , n और ℓ एक ही व्याख्या और उनके जटिल समकक्षों के रूप में महत्व है , लेकिन m नहीं रह गया एक अच्छा क्वांटम संख्या (हालांकि इसकी निरपेक्ष मूल्य है)। कक्षाओं एक मानकीकृत कार्तीय आधार के लिए सम्मान के साथ उनके आकार के आधार पर नए नाम दिए गए हैं।
कक्षीय ऊर्जा[संपादित करें]
एक इलेक्ट्रॉन (हाइड्रोजन परमाणुओं की तरह), एक कक्षीय (और इसके परिणामस्वरूप, कक्षीय में किसी भी इलेक्ट्रॉनों का) विशेष रूप से n चुना गया है की ऊर्जा के साथ परमाणुओं में। n = 1 कक्षीय परमाणु में संभव सबसे कम ऊर्जा है। की n एन प्रत्येक क्रमिक उच्च मूल्य ऊर्जा के एक उच्च स्तर की है, लेकिन अंतर के रूप में n बढ़ जाती है घट जाती है। उच्च n के लिए, ऊर्जा का स्तर इतना अधिक है कि इलेक्ट्रॉन आसानी से परमाणु से बच सकते हो जाता है। एकल इलेक्ट्रॉन परमाणुओं में, विभिन्न ℓ के साथ सभी स्तरों के भीतर n रहे हैं पतित, एक ही ऊर्जा है।। इस सन्निकटन नाभिक के चुंबकीय क्षेत्र के प्रभाव से और क्वांटम विद्युत प्रभाव से एक मामूली हद तक टूट गया है। उत्तरार्द्ध विशेष रूप से इलेक्ट्रॉनों कि नाभिक नजदीक जाना है, क्योंकि ये एक बहुत थोड़ा अलग परमाणु प्रभारी लग रहा है, यहां तक कि एक इलेक्ट्रॉन परमाणुओं में छोटे बंधन ऊर्जा मतभेदों को प्रेरित
कई इलेक्ट्रॉनों के साथ परमाणुओं में , एक इलेक्ट्रॉन की ऊर्जा न केवल अपनी कक्षा के आंतरिक गुणों पर , बल्कि अन्य इलेक्ट्रॉनों के साथ अपनी बातचीत पर निर्भर करता है। इन मुलाकातों अपने स्थानिक संभावना वितरण के विस्तार पर निर्भर करती है, और इसलिए कक्षाओं की ऊर्जा के स्तर पर ही नहीं n लेकिन यह भी पर ℓ निर्भर करते हैं। पक्ष ऊर्जा के उच्च मूल्यों के साथ जुड़े रहे हैं ; उदाहरण के लिए , 2p राज्य 2s राज्य की तुलना में अधिक है। जब ℓ=2 कक्षीय की ऊर्जा में वृद्धि इतनी बड़ी हो जाती एस- कक्षीय अगले उच्च खोल में की ऊर्जा ऊपर कक्षीय की ऊर्जा को पुश करने के रूप में ; जब ℓ=3 ऊर्जा खोल में दो चरणों उच्च धकेल दिया है। 3 डी कक्षाओं के भरने उत्पन्न नहीं होती है जब तक 4s कक्षाओं भर दिया गया है।
