ट्रांसयूरेनिक

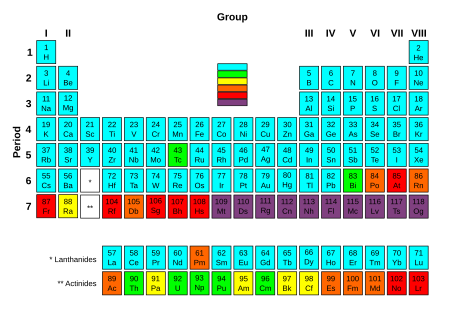
यूरेनियमोत्तर तत्व या परायूरेनियम तत्व या ट्रांसयूरेनिक तत्त्व (Transuranic elements) वे रासायनिक तत्त्व हैं, जिनका परमाणु भार ९२ से अधिक होता है। ९२, यूरेनियम का परमाणु भार है। अतः ये सभी आवर्त सारणी में यूरेनियम के बाद आते हैं। इनमें से कोई भी तत्त्व स्थिर नहीं होता है, व रेडियोधर्मी क्षय के उपरांत अन्य छोटे तत्त्वों में बदल जाते हैं।
आवर्त सारणी (Periodic table) को देखने से ज्ञात होगा कि प्रकृति में पाए जानेवाले तत्वों में यूरेनियम सबसे भारी है और इसकी परमाणु संख्या 92 है, परंतु कुछ ऐसे मनुष्यनिर्मित तत्व भी हैं जिनकी परमाणु संख्या 92 से अधिक है। इन तत्वों को हम यूरेनियमोत्तर तत्व, या परायूरेनियम तत्व, कहते हैं। ये सारे तत्व अस्थिर तथा रेडियोऐक्टिव गुण के हैं। इनकी खोज तत्वांतरण (transmutation) क्रियाओं द्वारा हुई और ये यूरेनियम तत्व से निर्मित किए गए। रासायनिक गुणों में इनमें बहुत समानता है, जिससे इन्हें एक्टिनाइड (actinide) श्रेणी में रखा जाता है।
यूरेनियमोत्तर तत्वों में प्लूटोनियम का महत्वपूर्ण स्थान है। इसका आरंभ में ही उपयोग परमाणु बम में हो चुका था और 1950 ई0 से पूर्व ही इसका उत्पादन भी अधिक मात्रा में हो चुका था। इससे उच्च परमाणु संख्या वाले तत्व अधिक अस्थिर होते तत्वों के समस्थानिक इतने अस्थिर हैं कि उनके रासायनिक प्रयोग रासायनिक गुण विरल मृदाओं (rare earths), या लैंथेनाइड (Lanthhanide) तत्वों से मिलते-जुलते हैं। यदि भविष्य में 104, या इससे अधिक परमाणु संख्या के तत्वों का निर्माण संभव हो सका, तो उनके गुण इनसे भिन्न होंगे। वे क्रमश: चौथे, पाँचवें, छठे आदि समूहों के तत्वों के समान होंगे।
यूरेनियमोत्तर तत्व[संपादित करें]
नाम --- संकेत --- परमाणु संख्या --- समस्थानिक भार
नेप्लूनियम --- NP 93 237
प्लूटोनियम--- Pu 94 244
ऐमेरिशियम --- Am 95 243
क्यूरियम--- Cm 96 245
बर्कीलियम--- Bk 97 247
कैलिफोर्नियम--- Cf 98 251
आइंस्टीनियम--- Es 99 254
फर्मियम--- Fm 100 256
मेंडलीवियम--- Md 101 256
नोबेलियम--- No 102 154
लारेंसियम--- Lw 103 157
नेप्चूनियम (NP)[संपादित करें]
93 परमाणु संख्यावाले इस तत्व की खोज 1940 ई0 में अमरीका के कैलिफोर्निया विश्वविद्यालय के मैकमिलन और एबिलसन द्वारा की गई। यूरेनियम पर न्यूट्रॉन की नाभिक प्रतिक्रिया द्वारा इस तत्व का निर्माण किया गया। रासायनिक प्रयोगों द्वारा इसकी उपस्थिति की पुष्टि हुई थी।
92यूरेनियम238 + 0न्यूट्रॉन1 --> 92 यूरेनियम239
(92U233 + on1 --> 92U239)
92यूरेनियम239 + 93नेप्चूनियम239 + -1इलेक्ट्रॉन0
(92U239 - 93Np239 + 1eo)
प्राप्त नेप्चूनियम समस्थानिक का अर्ध-जीवनकाल (half life period) 2.3 दिन है। नेप्चून ग्रह के आधार पर इसका नाम नेप्चूनियम रखा गया। 1942 ई. में इसके दूसरे समस्थानिक 237 की खोज हुई, जिसका अर्ध जीवनकाल 2.2 x106 वर्ष है। यह असमस्थानिक अन्य यूरेनियमोत्तर तत्वों की अपेक्षा कम घातक है। नेप्चूनियम के 11 समस्थानिक ज्ञात हैं, जिनकी भार संख्याएँ 231, 232, 233, 234, 235, 236, 237, 238, 239, 240 और 241 हैं। इसके रासायनिक गुण यूरेनियम से मिलते जुलते हैं।
प्लूटोनियम (Pu)[संपादित करें]
940 ई. में अमरीका के प्रसिद्ध वैज्ञानिक सीबोर्ग तथा अन्य साथियों ने इस तत्व की खोज की। यूरेनियम 238 समस्थानिक पर ड्यूट्रान कारणो की बौछार से बनेश् नेप्चूनियम 238 द्वारा इलेक्ट्रॉन मुक्त करने पर प्लूटोनियम रखा गया। 1941 ई. में प्लूटोनियम 239 की खोज हुई। यह समस्थानिक यूरेनियम पर मंद न्यूट्रॉन की प्रक्रिया द्वारा बनाया गया और नाभिकीय अनुसंधानों में अत्यंत महत्वपूर्ण सिद्ध हुआ। यूरेनियम नाभिक रिऐक्टर में इसका निर्माण सरलता से हो जाता है। इसी कारण इसके रासायनिक गुणों की भली प्रकार जाँच हो सकी है। इसके अनेक यौगिक भी बनाए गए हैं। यूरेनियम के अनेक आयस्कों के प्लूटोनियम अत्यंत सूक्ष्म मात्रा में मिला है। यह यूरेनियम पर प्राकृतिक स्रोतो से उत्पन्न न्यूट्रॉनों की प्रक्रिया द्वारा बनता रहता है।
प्लूटोनियम 239 यूरेनियम 235 की भाँति खंडित हो सकता है और नाभिक रिऐक्टरों में ईधंन की भाँति प्रयुक्त हुआ है। इसके 15 समस्थानिक अभी तक ज्ञात हैं, जिनकी भार संख्या 232 से 246 है। इसमें 244 भार वाला समस्थानिक सबसे स्थिर है और उसकी अर्ध जीवनावधि 7.6 x 107 वर्ष है।
ऐमेरिशियम (Am)-इस तत्व की खोज 1944 ई. में हुई। प्लूटोनियम 239 पर न्यूट्रॉन की बौछार द्वारा बने प्लूटोनियम 241 नाभिक द्वारा बीटा कण मुक्त करने पर इसका निर्माण होता है।
प्लूटोनियम 239 + न्यूट्रॉन --> प्लूटोनियम 240
प्लूटोनियम 240 + न्यूट्रॉन --> प्लूटोनियम 241
प्लूटोनियम 241 --> ऐमेरिशियम 241 + बीटा कण
ऐमेरिशियम के 10 समस्थानिक प्राप्त हैं जिनमें Am243 का अर्ध जीवनकाल सब से दीर्ध (8000 वर्ष) है रासायनिक प्रयोगों से ज्ञात है कि इसके 3 संयोजकता वाले यौगिक सर्वाधिक स्थायी हैं।
क्यूरियम (Cm)[संपादित करें]
इस तत्व की खोज 1944 ई. में ऐमेरिशियम से पहले हुई। इसका निर्माण प्लूटपेनियम 239 पर ऐल्फा कण की बौछार द्वारा किया गया।
प्लूटोनियम 239 + ऐल्फा कण --> क्यूनियम 242 + न्यूट्रॉन
प्रसिद्ध वैज्ञानिक श्रीमती मैडम क्यूरी की समृति में इसका नाम 'क्यूरियम' रखा गया। इस तत्व के 13 समस्थानिक ज्ञात हैं, जिनमें 245 भार का समस्थानिक सबसे स्थिर है (अर्ध जीवन अवधि 11,000 वर्ष)।
कैलिफोनियम (Cf)[संपादित करें]
1950 ई. में क्यूरियम परमाणुओं पर ऐल्फा कणों की अभिक्रिया द्वारा यह तत्व निर्मित किया गया। अमरीका के कैलिफार्निया प्रदेश के आधार पर इसे कैलिफार्निया नाम मिला। कैलिफार्नियम के 11 समस्थानिक ज्ञात हैं, जिनमें 251 भार का समस्थानिक सबसे स्थिर है (अर्धजीवन अवधि 700 वर्ष)।
आइंस्टीनियम (Es)[संपादित करें]
प्रशांत महासागर में 1952 ई. में परमाणु विस्फोट के खंड मे इस तत्व की सर्वप्रथम खोज हुई थी। 1954 ई. के लगभग एक ही समय में अमरीका के कैलिफोर्निया विश्वविद्यालय तथा आर्गन राष्ट्रीय प्रयोगशाला और स्वीडन की स्टॉकहोमश् प्रयोगशाला में इस तत्व का निर्माण हुआ। यूरेनियम 238 पर नाईट्रोजन नाभिक की बौछार द्वारा इसे सर्वप्रथम बनाया गया था। विश्वप्रसिद्धश् वैज्ञानिक आइंस्टी के समान में इस तत्व का नाम आइंस्टीनियम रखा गया। अभी तक इसके दस समस्थानिक ज्ञात है जिनमें सबसे स्थिर समस्थानिक Es 254 की अर्ध-जीवनावधि 280 दिन है।
फर्मियम (Fm)[संपादित करें]
यूरेनियम पर तीव्र ऑक्सिजन आयनों की क्रिया द्वारा इसका निर्माण किया गया था। 1952 ई. के प्रशांत सागर के विस्फोट में इसके कण भी पाए गए थे। इसके सात समस्थानिक ज्ञात हैं, जिनमें 256 भार का समस्थानिक सबसे स्थायल है।
मेंडलीवियम (Md)[संपादित करें]
सर्वप्रथम 1955 ई. में इस तत्व का निर्माण हुआ। आइंस्टीनियम पर ऐल्फा कण के आक्रमण द्वारा इसका निर्माण संभव हुआ। प्रसिद्ध रूसी रसायनज्ञ मेंडलीव की स्मृति में इसका नाम मेंडलीवियम रखा गया। यह अत्यंत अस्थायी परमाणु हैं।
नोवेलियम (No)[संपादित करें]
1957 ई. में स्वीडन के नोबेल संस्थान में क्यूरियम244 नाभिक पर कार्बन आयन के आक्रमण द्वारा इसका सर्वप्रथम निर्माण हुआ। नोबेल पुरस्कार के संस्थापक नोबले के समान में इसका नाम नोबेलियम रखा गया।
लारैशियम (Lw)[संपादित करें]
1962 ई. में कैलिफोर्निया विश्वविद्यालय की लारेंस प्रयोगशाला में इस तत्व के निर्माण की घोषणा हुई। ऐसा अनुमान है कि 257 भार के कुछ परमाणु इन प्रयोगों द्वारा बने थे इस तत्व का नाम लारेंशियम प्रस्तावित किया गया है।
सन्दर्भ[संपादित करें]
आवर्त सारणी
| ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Group | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||
| Alkali metals | Alkaline earth metals | Pnictogens | Chalcogens | Halogens | Noble gases | |||||||||||||||||||||||||||
| Period |
||||||||||||||||||||||||||||||||
| 2 | ||||||||||||||||||||||||||||||||
| 3 | ||||||||||||||||||||||||||||||||
| 4 | ||||||||||||||||||||||||||||||||
| 5 | ||||||||||||||||||||||||||||||||
| 6 | * | |||||||||||||||||||||||||||||||
| 7 | ** | |||||||||||||||||||||||||||||||
| * Lanthanides | ||||||||||||||||||||||||||||||||
| ** Actinides | ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
