"ऊष्माक्षेपी अभिक्रिया": अवतरणों में अंतर
Content deleted Content added
No edit summary टैग: Reverted यथादृश्य संपादिका मोबाइल संपादन मोबाइल वेब संपादन |
रोहित साव27 (वार्ता | योगदान) 2401:4900:4630:581b:600b:84b3:8558:ea90 के सम्पादनों को हटाया (रोहित साव27 के पिछले संस्करण को पुनः स्थापित किया।) टैग: Manual revert |
||
| पंक्ति 1: | पंक्ति 1: | ||
{{आधार}} |
{{आधार}} |
||
[[चित्र:ac com.svg|300px|thumb|right|किसी ऊष्माक्षेपी अभिक्रिया का ऊर्जा-प्रोफाइल]] |
[[चित्र:ac com.svg|300px|thumb|right|किसी ऊष्माक्षेपी अभिक्रिया का ऊर्जा-प्रोफाइल]] |
||
वह [[रासायनिक अभिक्रिया]] '''उष्माक्षेपी''' (exothermic reaction) कहलाती है जिसमें [[ऊष्मा|उष्मा]] के रूप में [[ऊर्जा|उर्जा]] प्राप्त होती है। इसके विपरीत रासायनिक अभिक्रिया [[उष्माशोषी अभिक्रिया|उष्माशोषी]] कहलाती है। रासायनिक अभिक्रिया के रूप में व्यक्त करने पर - |
|||
: अभिकारक → उत्पाद + उर्जा (उष्मा के रूप में) |
: अभिकारक → उत्पाद + उर्जा (उष्मा के रूप में) |
||
10:20, 19 अक्टूबर 2021 का अवतरण
| यह लेख एक आधार है। जानकारी जोड़कर इसे बढ़ाने में विकिपीडिया की मदद करें। |
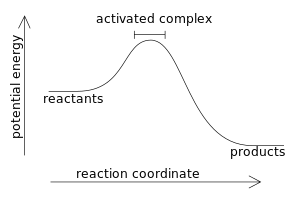
वह रासायनिक अभिक्रिया उष्माक्षेपी (exothermic reaction) कहलाती है जिसमें उष्मा के रूप में उर्जा प्राप्त होती है। इसके विपरीत रासायनिक अभिक्रिया उष्माशोषी कहलाती है। रासायनिक अभिक्रिया के रूप में व्यक्त करने पर -
- अभिकारक → उत्पाद + उर्जा (उष्मा के रूप में)
उदाहरण के लिए, हाइड्रोजन का जलना एक ऊष्माक्षेपी अभिक्रिया है।
- 2H2 (g) + O2 (g) → 2H2O (g)
- ΔH = −483.6 kJ/mol of O2[1]
Example- emission of light H+ + OH- H2O
सन्दर्भ
- ↑ "संग्रहीत प्रति". मूल से 8 जुलाई 2013 को पुरालेखित. अभिगमन तिथि 5 सितंबर 2013.
