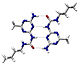
हाइड्रोजन आबंध


हाइड्रोजन बन्ध एक ऋणात्मक परमाणु और नाइट्रोजन, ऑक्सीजन या फ्लोरीन से जुड़े एक हाइड्रोजन परमाणु के बीच द्विध्रुव-द्विध्रुव बल का परिणाम होता है। हाइड्रोजन बन्ध की ऊर्जा (लगभग ५ से ३० किलोजूल/मोल) एक मन्द (Weak) संयोजी बन्ध(Covalent bond) -(१५५ कि.जी/मोल) से तुलनीय होती है। एक खास संयोजी बन्ध अन्तराण्विक हाइड्रोजन बन्ध से लगभग २० गुना शक्तिशाली होता है। यह बन्ध अणुओं के बीच (अन्तराण्विक), या एक ही अणुके भिन्न भागों के बीच भी बन सकते हैं।[2] हाइड्रोजन बन्ध एक मजबूत स्थिर डाइपोल-डाइपोल वान डर वाल बल होता है, किन्तु संयोजी बंध, आयनिक बन्ध और धात्विक बन्धों से कमज़ोर होता है। हाइड्रोजन बन्ध संयोजी बंध एवं इलेक्ट्रोस्टैटिक अन्तराण्विक आकर्षण के बीच का होता है। इस प्रकार के बन्ध कार्बनिक अणुओं (डी एन ए) एवं अकार्बनिक अणुओं (जल) दोनों में ही पाए जाते हैं।
अन्तराण्विक हाइड्रोजन बन्ध ही जल के ऊंचे उबलने के बिन्दु (१००° से) के लिए उत्तरदायी होता है। यही बल द्वितीयक, तृतीयक एवं चतुर्थ श्रेणी के प्रोटीन एवं न्यूक्लिक अम्ल की संरचनाएं बनाता है।
&
-@abhishekmarwadi02
हाइड्रोजन बन्ध :-
किसी अणु के हाइड्रोजन परमाणु तथा किसी समान अथवा भिन्न प्रकार के दूसरे अणु के प्रबल विद्युत् ऋणात्मक परमाणु के बीच के आकर्षण बल को हाइड्रोजन बन्ध कहते है। इसे बिंदुकित रेखा प्रदर्शित करते हैं। हाइड्रोजन बन्ध दो प्रकार का होता है: (1) अन्तर अणुक हाइड्रोजन बन्ध, जैसे - N H 3
में ।
(2) अन्तःअणुक हाइड्रोजन बन्ध, जैसे - ऑर्थोनाइट्रोफीनॉल में yas
इतिहास
[संपादित करें]लुई पाउलिंग ने अपनी पुस्तक 'रासायनिक बन्ध की प्रकृति' में लिखा है कि टीएफ विनमिल ने सबसे पहले हाइड्रोजन बन्ध का उल्लेख किया है। (१९१२ में)। मूर और विनमिल ने हाइड्रोजन बन्ध की संकल्पना का उपयोग इस बात कू व्याख्या के लिये किया कि ट्राईमेथिलअनोनियम हाइड्रॉक्साइड, टेट्रामेथिलअमोनियम हाइड्रॉक्साइड की अपेक्षा कमजोर क्षार है। पानी में हाइड्रोजन बन्ध का वर्णन १९२० में आया (Latimer and Rodebush (JACS, 42, 1419).
== बाहरी कड़ियाँ==hydrogen bond heavy negative charge example O, N, S, F etc.। Valence bond with Cobain
सन्दर्भ
[संपादित करें]- ↑ Felix H. Beijer, Huub Kooijman, Anthony L. Spek, Rint P. Sijbesma, E. W. Meijer (1998). "Self-Complementarity Achieved through Quadruple Hydrogen Bonding". Angew. Chem. Int. Ed. 37: 75–78. डीओआइ:10.1002/(SICI)1521-3773(19980202)37:1/2<75::AID-ANIE75>3.0.CO;2-R.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "हाइड्रोजन बन्ध".
- George A. Jeffrey. An Introduction to Hydrogen Bonding (Topics in Physical Chemistry). Oxford University Press, USA (March 13, 1997). ISBN 0-19-509549-9
- Robert H. Crabtree, Per E. M. Siegbahn, Odile Eisenstein, Arnold L. Rheingold, and Thomas F. Koetzle (1996). "A New Intermolecular Interaction: Unconventional Hydrogen Bonds with Element-Hydride Bonds as Proton Acceptor". Acc. Chem. Res. 29 (7): 348–354. डीओआइ:10.1021/ar950150s.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- Alexander F. Goncharov, M. Riad Manaa, Joseph M. Zaug, Richard H. Gee, Laurence E. Fried, and Wren B. Montgomery (2005). "Polymerization of Formic Acid under High Pressure". Phys. Rev. Lett. 94 (6): 065505. डीओआइ:10.1103/PhysRevLett.94.065505.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- F. Cordier, M. Rogowski, S. Grzesiek and A. Bax (1999). "Observation of through-hydrogen-bond (2h)J(HC') in a perdeuterated protein". J Magn Reson. 140: 510–2. डीओआइ:10.1006/jmre.1999.1899.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- R. Parthasarathi, V. Subramanian, N. Sathyamurthy (2006). "Hydrogen Bonding Without Borders: An Atoms-In-Molecules Perspective". J. Phys. Chem. (A). 110: 3349–3351.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
| यह भौतिकी से सम्बन्धित लेख एक आधार है। जानकारी जोड़कर इसे बढ़ाने में विकिपीडिया की मदद करें। यह लेख विकिपरियोजना भौतिकी का भाग है। |