संयोजक कोश इलेक्ट्रॉन प्रतिकर्षण सिद्धान्त
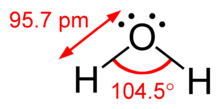
संयोजक कोश इलेक्ट्रॉन प्रतिकर्षण सिद्धान्त रासायनिकी में प्रयुक्त एक सैद्धांतिक प्रतिमान है जो केन्द्रीय परमाणुओं के निकटवर्ती इलेक्ट्रॉन युग्मों की संख्या से विभिन्न अणुओं की भूमिति का पूर्वानुमान करता है। [1] लूइस अवधारणा अण्वों की आकृति की व्याख्या में असमर्थ है। संयोजक कोश इलेक्ट्रॉन प्रतिकर्षण सिद्धान्त सहसयोजी आकृति को समझने हेतु एक सरल कार्यविधि उपलब्ध कराता है। यह विधि सर्वप्रथम सन् 1941 में नेविल सिज्विक तथा पॉवेल ने परमाणुओं के संयोजक कोश में उपस्थित इलेक्ट्रॉन युग्मों के बीच प्रतिकर्षण अन्योन्यक्रियाओं के आधार पर प्रतिपादित की थी।
इस विधि को रॉबर्ट नाइहॉल्म तथा रॉनल्ड गिलेस्पी ने सन् 1957 में इलेक्ट्रॉनों के एकाकी युग्मों तथा आबन्ध युग्मों के महत्त्वपूर्ण अन्तरों की व्याख्या करते हुए अधिक विकसित तथा संशोधित किया। एकाकी इलेक्ट्रॉन युग्म केन्द्रीय परमाणु पर स्थानीय होते हैं, जबकि प्रत्येक आबन्ध युग्म दो परमाणुओं के बीच सहभाजित होता है। अतः किसी अणु में आबन्ध इलेक्ट्रॉन युग्म की अपेक्षा एकाकी युग्म अधिक स्थान घेरते हैं। इसके फलस्वरूप एकाकी इलेक्ट्रॉन युग्मों के मध्य एकाकी युग्म—आबन्ध युग्म तथा आबन्ध युग्म—आबन्ध युग्म की अपेक्षा अधिक प्रतिकर्षण होता है। इन प्रतिकर्षण प्रभावों के कारण अणु की सम्भावित आकृति में भिन्नता होती है तथा अणु के आबन्ध कोणों में भी अन्तर आ जाता है।
इस सिद्धान्त आधार यह है कि एक परमाणु के चतुर्दिक् संयोजक इलेक्ट्रॉन युग्म परस्पर को प्रतिकर्षित करते हैं। प्रतिकर्षण जितना अधिक होगा, अणु की ऊर्जा उतनी ही अधिक (कम स्थिर) होगी। इसलिए, एक अणु की अनुमानित आणविक ज्यामिति वह है जिसमें जितना सम्भव हो उतना कम प्रतिकर्षण होता है। गिलेस्पी ने इस बात पर बल दिया है कि पौली अपवर्जन नियम के कारण इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण स्थिरवैद्युतिक प्रतिकर्षण की तुलना में आण्विक ज्यामिति का निर्धारण करने में अधिक महत्त्वपूर्ण है। [2]
मूल धारणाएँ[संपादित करें]
संयोजक कोश इलेक्ट्रॉन प्रतिकर्षण सिद्धान्त की मूल धारणाएँ हैं:
- अण्वाकृति, केन्द्रीय परमाणु के निकटवर्ती उपस्थित संयोजक कोश इलेक्ट्रॉन युग्मों (संयोजित अथवा असंयोजित) की संख्या पर निर्भर करती है।
- केंद्रीय परमाणु के संयोजकता कोश में उपस्थित इलेक्ट्रॉन युग्म एक दूसरे को प्रतिकर्षित करते हैं, क्योंकि उनके इलेक्ट्रॉन अभ्र पर ऋणात्मक आवेश होता है।
- ये इलेक्ट्रॉन युग्म त्रिविम में उन स्थितियों में अवस्थित होने का प्रयत्न करते हैं, जिसके फलस्वरूप उनमें प्रतिकर्षण कम से कम हो। इस स्थिति में उनके मध्य अधिकतम दूरी होती है।
- संयोजकता कोश को एक गोले के रूप में माना जाता है तथा इलेक्ट्रॉन युग्म गोलीय सतह पर एक दूसरे से अधिकतम दूरी पर स्थित होते हैं।
- बह्वाबन्ध की एक एकल इलेक्ट्रॉन युग्म के रूप में तथा इस बह्वाबन्ध के दो या तीन इलेक्ट्रॉन युग्मों को एकल सुपर युग्म समझा जाता है।
- यदि अणु को दो या अधिक अनुनाद संरचनाओं द्वारा दर्शाया जा सके तो इस स्थिति में यह मॉडल ऐसी प्रत्येक संरचना पर लागू होता है।
- इलेक्ट्रॉन युग्मों के बीच प्रतिकर्षण अन्योन्यक्रियाएँ निम्नोक्त क्रम में घटती हैं-
एकाकी युग्म—एकाकी युग्म > एकाकी युग्म—आबन्ध युग्म > आबन्ध युग्म—आबन्ध युग्म
AXE विधि[संपादित करें]
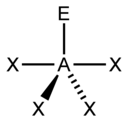
संयोजक कोश इलेक्ट्रॉन प्रतिकर्षण सिद्धान्त को लागू करते समय इलेक्ट्रॉन गणना की "AXE विधि" का प्रायः प्रयोग किया जाता है। एक केंद्रीय परमाणु के चारों ओर इलेक्ट्रॉन जोड़े एक सूत्र AX m E n द्वारा दर्शाए जाते हैं, जहाँ A एक केन्द्रीय परमाणु का प्रतिनिधित्व करता है। प्रत्येक X, A से आबन्धित एक परमाणु का प्रतिनिधित्व करता है। प्रत्येक E केन्द्रीय परमाणु पर इलेक्ट्रॉनों की एक एकाकी युग्म का प्रतिनिधित्व करता है। [3] X और E की कुल संख्या को त्रिविम संख्या के रूप में जाना जाता है। उदाहरणार्थ एक अणु AX3 E2 में, परमाणु A की त्रिविम संख्या 5 होती है।
मुख्य-वर्ग तत्त्व[संपादित करें]
मुख्य-वर्ग तत्त्वों हेतु, त्रिविम रूप से सक्रिय एकाकी युग्म E होते हैं जिनकी संख्या 0 से 3 के मध्य भिन्न हो सकती है।
| त्रिविम संख्या | 0 एकाकी युग्म वाले आण्विक भूमिति [4] | 1 एकाकी युग्म वाले आण्विक भूमिति [3] | 2 एकाकी युग्म वाले आण्विक भूमिति [3] | 3 एकाकी युग्म वाले आण्विक भूमिति [3] |
|---|---|---|---|---|
| 2 | ||||
| 3 | 
|

|
||
| 4 | 
|

|

|
|
| 5 | 
|
|

|

|
| 6 | 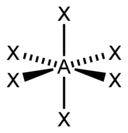
|

|

|
|
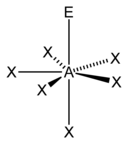
| 7 | 
|
|
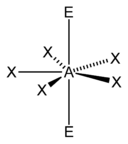
|
|
| 8 |
| आण्विक प्रकार | Shape[3] | इलेक्ट्रॉन व्यवस्था [3] एकाकी युग्मों सहित, हल्के पीले दर्शाया | भूमिति [3] एकाकी युग्मों के अतिरिक्त | उदाहरण |
|---|---|---|---|---|
| AX 2 E 0 | रैखीय | BeCl2, [1] CO2 [5] | ||
| AX 2 E 1 | वक्र | 
|

|
|
| AX2E2 | वक्र | 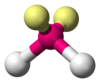
|

|
H2O,[3] OF2[6] |
| AX2E3 | रैखिक | 
|
||
| AX3E0 | समतल त्रिकोणीय | 
|

|
|
| AX3E1 | त्रिकोण पिरामिडीय | 
|

|
NH3,[3] PCl3[6] |
| AX3E2 | T-आकार | 
|

|
ClF3,[3] BrF3[6] |
| AX4E0 | चतुष्फलकीय अणु ज्यामिति | 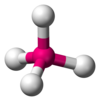
|

|
CH4,[3] PO3−4, SO2−4,[5] ClO−4,[1] XeO4[6] |
| AX4E1 | सी सौ | 
|
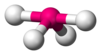
|
SF4[3][6] |
| AX4E2 | समतल वर्गीय | 
|

|
XeF4[3] |
| AX5E0 | त्रिकोण द्विपिरामिडीय | 
|

|
PCl5[3] |
| AX5E1 | वर्ग पिरामिडीय | 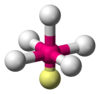
|

|
|
| AX5E2 | समतल पंचभुजीय | 
|

|
XeF−5[6] |
| AX6E0 | अष्टफलकीय | 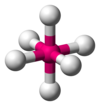
|

|
SF6[3] |
| AX6E1 | पंचभुज पिरामिडीय | 
|

|
XeOF−5,[7] IOF2−5[7] |
| AX7E0 | पंचभुज द्विपिरामिडीय | 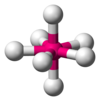
|

|
|
| AX8E0 | वर्ग ऐण्टी-प्रिस्मीय | 
|

|
IF−8, XeF82- in (NO)2XeF8 |
सन्दर्भ[संपादित करें]
- ↑ अ आ इ Jolly, W. L. (1984). Modern Inorganic Chemistry. McGraw-Hill. पपृ॰ 77–90. आई॰ऍस॰बी॰ऍन॰ 978-0-07-032760-3.
- ↑ Gillespie, R. J. (2008). "Fifty years of the VSEPR model". Coord. Chem. Rev. 252 (12–14): 1315–1327. डीओआइ:10.1016/j.ccr.2007.07.007.
- ↑ अ आ इ ई उ ऊ ए ऐ ओ औ क ख ग घ ङ Petrucci, R. H.; W. S., Harwood; F. G., Herring (2002). General Chemistry: Principles and Modern Applications (8th संस्करण). Prentice-Hall. आई॰ऍस॰बी॰ऍन॰ 978-0-13-014329-7. सन्दर्भ त्रुटि:
<ref>अमान्य टैग है; "Petrucci" नाम कई बार विभिन्न सामग्रियों में परिभाषित हो चुका है - ↑ Petrucci, R. H.; W. S., Harwood; F. G., Herring (2002). General Chemistry: Principles and Modern Applications (8th संस्करण). Prentice-Hall. पपृ॰ 413–414 (Table 11.1). आई॰ऍस॰बी॰ऍन॰ 978-0-13-014329-7.
- ↑ अ आ Miessler, G. L.; Tarr, D. A. (1999). Inorganic Chemistry (2nd संस्करण). Prentice-Hall. पपृ॰ 54–62. आई॰ऍस॰बी॰ऍन॰ 978-0-13-841891-5.
- ↑ अ आ इ ई उ ऊ Housecroft, C. E.; Sharpe, A. G. (2005). Inorganic Chemistry (2nd संस्करण). Pearson. आई॰ऍस॰बी॰ऍन॰ 978-0-130-39913-7.
- ↑ अ आ Baran, E. (2000). "Mean amplitudes of vibration of the pentagonal pyramidal XeOF−5 and IOF2−5 anions". J. Fluorine Chem. 101: 61–63. डीओआइ:10.1016/S0022-1139(99)00194-3.
