घाव का भरना
घाव का भरना या जख्म की मरम्मत एक जटिल प्रक्रिया है जिसके द्वारा त्वचा (या कोई अन्य अवयव) चोट लगने के बाद स्वयं की मरम्मत करता है।[1] सामान्य त्वचा में, उपर्कला (सबसे बाहरी पर्त) और अंतर्कला (भीतरी पर्त) एक स्थिर-दशा के संतुलन में रहती है और बाह्य वातावरण के विरूद्ध एक रक्षात्मक अवरोध बनाए रखती है। रक्षात्मक अवरोध के टूटते ही घाव भरने की सामान्य (शरीरक्रियात्मक) प्रक्रिया तुरंत शुरू हो जाती है। जख्म की मरम्मत का आदर्श प्रतिमान तीन या चार क्रमिक,[2] किंतु अतिव्यापी अवस्थाओं में विभाजित किया गया है: (1) रक्तस्रावस्तम्भन (खून के बहने को रोकना) (इसे कुछ लेखकों ने कोई अवस्था नहीं माना है), (2) शोथ, (3) प्रफलन और (4) पुर्ननिर्माण.[3] त्वचा पर चोट लगने पर, जख्म की मरम्मत के लिये बारीकी से संचालित प्रपात के रूप में एक जटिल जैवरसायनिक घटनाक्रम होता है।[2] चोट लगने के बाद मिनटों में ही, थक्काकोशिकाएं (थ्राम्बोसाइट) जख्म के स्थान पर जमा होकर एक फाइब्रिन थक्के का निर्माण करते हैं। यह थक्का सक्रिय रक्तस्राव को रोकने (रक्तस्रावस्तम्भन) का कार्य करता है।
शोथकारी अवस्था में, जीवाणुओं और अवशेषों का भक्षक कोशिकाओं द्वारा भक्षण कर लिया जाता है, तथा ऐसे कारक मुक्त होते हैं जो प्रफलन अवस्था में लगी कोशिकाओं का प्रवास और विभाजन करवाते हैं।
प्रफलन अवस्था में रक्तवाहिकानिर्माण, कोलेजन भंडारण, कणांकुर ऊत्तकों का निर्माण, उपत्वचीकरण और घाव का संकुचन होता है।[4] रक्तवाहिका निर्माण में वाहिकीय अंतर्कलीय कोशिकाओं द्वारा नई रक्तवाहिकाओं का निर्माण होता है।[5] तंतुविकसन और कणांकुर ऊत्तक के निर्माण में, तंतु कोशिकाएं उत्पन्न होती हैं और कोलेजन तथा फाइब्रोनेक्टिन का स्राव करके नई, कार्यकारी बाह्यकोशिकीय आधात्री (ईसीएम (ECM)) का निर्माण करती हैं।[4] साथ ही, उपर्त्वचा का पुर्नउपत्वचीकरण होता है, जिसमें उपर्त्वचीय कोशिकाएं प्रफलित होती हैं और घाव के ऊपर 'रेंगकर' नए ऊत्तक के लिये आवरण उपलब्ध करती हैं।[6]
संकुचन में, घाव को पेशीतंतु कोशिकाओं की क्रिया द्वारा आकार में और छोटा किया जाता है, जो घाव के सिरों पर एक पकड़ पैदा करती हैं तथा चिकनी पेशी कोशिकाओं के जैसी एक प्रक्रिया का प्रयोग करके स्वयं को संकुचित करती हैं। जब इन कोशिकाओं की भूमिका पूरी होती है, तब अनावश्यक कोशिकाओं की स्वतः कोशिकामृत्यु हो जाती है।[4]
परिपक्वन और पुर्ननिर्माण अवस्था में, कोलेजन तनाव रेखाओं के साथ-साथ पुर्ननिर्मित और पुर्नव्यवस्थित होता है तथा जिन कोशिकाओं की जरूरत नहीं होती उन्हें स्वतः कोशिकामृत्यु द्वारा हटा दिया जाता है।
लेकिन, यह प्रक्रिया न केवल जटिल, बल्कि भंगुर भी होती है, तथा इसके विचलित होने या असफल होने की संभावना होती है जिससे दीर्घकालिक नासूर जख्म बन सकते हैं। इसमें मदद करने वाले कारकों में मधुमेह, शिरा या धमनी रोग, बुढ़ापा और संक्रमण शामिल हैं।[7]
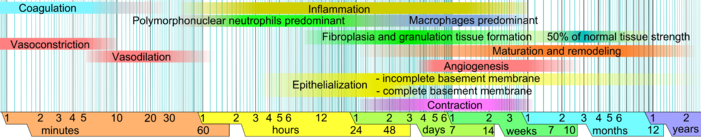
प्रारंभिक बनाम कोशिकीय अवस्था[संपादित करें]
जैसा कि ऊपर बताया गया है, घावों की मरम्मत आदर्श रूप से रक्तस्रावस्तम्भन, शोथकारी, प्रफलन और पुर्ननिर्माण अवस्थाओं में विभाजित की गई है। एक उपयोगी रचना होने पर भी, यह प्रतिमान व्यक्तिगत अवस्थाओं में काफी अतिव्यापकता का प्रयोग करता है। हाल ही में एक पूरक प्रतिमान का वर्णन किया गया है,[1] जिसमें घाव की मरम्मत के कई तत्व अधिक स्पष्ट रूप से प्रस्तुत किये गए हैं। इस नए प्रतिमान का महत्व पुर्ननिर्माण चिकित्सा और ऊत्तक इंजीनियरिंग के क्षेत्रों में इसके उपयोग से और भी अधिक परिलक्षित हो जाता है। इस संरचना में, जख्म के भरने की प्रक्रिया को दो मुख्य अवस्थाओं में विभाजित किया गया है: प्रारंभिक अवस्था और कोशिकीय अवस्था :[1]
प्रारंभिक अवस्था में, जो त्वचा को लगने के तुरंत बाद शुरू हो जाती है, प्रपातीय आण्विक और कोशिकीय घटनाएं होती हैं जिनसे रक्तस्रावस्तम्भन हो जाता है और एक शीघ्र, कामचलाऊ बाह्यकोशिकीय आधात्री का निर्माण होता है— जो कोशिकीय संलगन और उसके बाद के कोशिकीय प्रफलन लिये रचनात्मक आधार उपलब्ध करता है।
प्रारंभिक अवस्था के बाद कोशिकीय अवस्था आती है, जिसमें कई तरह की कोशिकाएं मिल कर शोथजन्य प्रतिक्रिया शुरू करने, कणांकुर ऊत्तक के संश्लेषण और उपर्त्वचीय पर्त को पनर्स्थापित करने का काम करती हैं।[1] कोशिकीय अवस्था के उपविभाग हैं – (1) महाभक्षक और शोथजन्य अंश (1-2 दिनों के भीतर), (2) उपर्त्वचीय- मेसेनकाइमल अंतर्क्रिया – पुर्नउपर्त्वचीकरण (फेनोवर्ग कुछ घंटों में बदल जाते हैं, प्रवास 1 या दो दिनों में शुरू हो जाता है), (3) तंतुकोशिकाएं और पेशीतंतुकोशिकाएं - विकासात्मक व्यवस्था, कोलेजन उत्पादन और आधात्रि संकुचन (चौथे दिन से चौदहवें दिन के बीच), (4) अंतर्कलीय कोशिकाएं और रक्तवाहिकानिर्माण (चौथे दिन प्रारंभ होती है), (5) त्वचीय आधात्रि – निर्माण (चौथे दिन शुरू, 2 सप्ताह तक चलता है) और परिवर्तन (घाव के आकार के अनुसार - 2 सप्ताह बाद शुरू होकर हफ्तों से महीनों तक चलता है) के तत्व.[1]
शोथकारी अवस्था[संपादित करें]
शोथकारी अवस्था के शुरू होने के ठीक पहले, रक्तस्राव अवरोध की प्राप्ति या फाइब्रिन थक्के के जरिये रक्तस्रावस्तम्भन या रक्तस्राव रोकने के लिये थक्काकरण प्रपात होता है। उसके बाद, विभिन्न घुलनशील कारक (कीमोकाइन और साइटोकाइन सहित) मुक्त किये जाते हैं जो ऐसी कोशिकाओं को आकर्षित करते हैं जो, घाव की मरम्मत की प्रफलन अवस्था को शुरू करने वाले अणुओं को मुक्त करने के अलावा कचरे, जीवाणुओं और क्षतिग्रस्त ऊतकों का भक्षण भी करती हैं।
थक्काकरण प्रपात[संपादित करें]
जब ऊत्तक पहली बार जख्मी होता है, तो रक्त कोलेजन के संपर्क में आता है, जिससे रक्त की थक्का कोशिकाएं शोथकारी कारकों का स्राव शुरू करने लगती हैं।[9] थक्का कोशिकाएं उन कोशिका झिल्लियों पर ग्लायकोप्रोटीनों का स्राव भी करती हैं जो उन्हें एक दूसरे से चिपक कर और एकत्रित होकर एक पिंड बनाने में मदद करते हैं।[4]
फाइब्रिन और फाइब्रोनेक्टिन आपस में उलझ कर एक डाट का निर्माण करते हैं जो प्रोटीनों और कणों को फंसाकर और रक्तहानि होने से रोकता है।[10] यह डाट फाइब्रिन-फाइब्रोनेक्टिन कोलेजन के जमा होने तक घाव के लिये मुख्य रचनात्मक आधार का काम करता है।[4] प्रवासशील कोशिकाएं इस डाट का प्रयोग रेंग कर आगे बढ़ने के लिये एक आधात्रि के रूप में करती हैं और थक्काकोशिकाएं इससे चिपक कर कारकों का स्राव करते हैं।[4] थक्का अंततः विघटित हो जाता है और उसका स्थान कणांकुर ऊत्तक और बाद में कोलेजन ले लेता है।
जख्म होने के थोड़ी देर बाद सबसे अधिक संख्या में मौजूद कोशिकाएं, थक्का कोशिकाएं रक्त में ईसीएम (ECM) प्रोटीनों सहित कई वस्तुओं और विकास कारकों सहित साइटोकाइनों का स्राव करती हैं।[9] विकास कारक कोशिकाओं को उत्तेजित करके उनके विभाजन की दर को बढ़ाते हैं। थक्का कोशिकाएं अन्य शोथसहायक कारकों जैसे, सीरोटॉनिन, ब्रैडीकाइनिन, प्रास्टाग्लैंडिनों, प्रास्टासाइक्लिनों, थ्राम्बाक्सेन और हिस्टामाइन का भी स्राव करती हैं,[2] जो कई उद्देश्यों को पूरा करते हैं जिनमें उस क्षेत्र में कोशिका-प्रफलन और प्रवास में वृद्धि और रक्त वाहिकाओं का चौड़ा होकर खरखरा बनना शामिल है।
वाहिकासंकुचन और वाहिकाप्रसरण[संपादित करें]
रक्त वाहिका के फटने के तुरंत बाद, फटी हुई कोशिका झिल्लियां थ्राम्बाक्सेनों और प्रस्टाग्लैंडिनों जैसे शोथकारक कारकों का स्राव करती हैं, जो वाहिका का संकुचन करके रक्तहानि से बचाव और उस स्थान में शोथकारी कोशिकाओं और कारकों का जमाव करते हैं।[2] यह वाहिकासंकुचन पांच से दस मिनट तक बना रहता है, जिसके बाद रक्तवाहिकाओं का फैलाव यानी वाहिकाप्रसरण होता है, जो चोट लगने के 20 मिनटों बाद शीर्ष पर पहुंच जाता है।[2] वाहिकाप्रसरण थक्का कोशिकाओं और अन्य कोशिकाओं द्वारा निर्गमित कारकों का परिणाम होता है। वाहिकाप्रसरण में लिप्त मुख्य कारक हिस्टामाइन होता है।[2][9] हिस्टामाइन रक्तवाहिकाओं को छिद्रमय भी बनाता है, जिससे ऊत्तक सूज जाता है क्योंकि रक्तप्रवाह से प्रोटीन निकलकर बाह्यवाहिका स्थान में चले जाते हैं, जो उसके ऑस्मोलर भार को बढ़ा देता है तथा उस क्षेत्र में पानी को अवशोषित कर लेता है।[2] रक्तवाहिकाओं की बढ़ी हुई पारगम्यता श्वेताणुओं जैसी शोथकारी कोशिकाओं को रक्तप्रवाह से घाव में प्रवेश करने में मदद करती है।[11][12]
बहुरूपीनाभिकीय न्यूट्रोफिल[संपादित करें]
जख्मी होने के एक घंटे के भीतर, बहुरूपनाभिकीय न्यूट्रोफिल (पीएमएन (PMN)) घाव-स्थल पर पहुंच जाते हैं और चोट लगने के बाद के पहले दो दिनों में घाव की मुख्य कोशिकाओं का रूप धारण कर लेते हैं, खासकर दूसरे दिन वे बड़ी संख्या में होते हैं।[13] उन्हें उस स्थान पर फाइब्रोनेक्टिन, विकास कारकों और काइनिन जैसे पदार्थों द्वारा आकर्षित किया जाता है। न्यूट्रोफिल कचरे और जीवाणुओं का भक्षण करते हैं और 'श्वसन विस्फोट' द्वारा मुक्त कणों का निर्गम करके जीवाणुओं का नाश भी करते हैं।[14][15] वे प्रोटिएज का स्राव भी करते हैं जो हानिग्रस्त ऊत्तक को विघटित करके घाव की सफाई भी करते हैं। न्यूट्रोफिल की अपने कार्यों को पूरा करने के बाद साधारणतया स्वतः कोशिकामृत्यु हो जाती है और उनका महाभक्षकों द्वारा भक्षण और अवक्रमण कर दिया जाता है।[16]
उस क्षेत्र में प्रवेश करने वाले अन्य श्वेताणुओं में हेल्पर टी कोशिकाएं शामिल होती हैं, जो साइटोकाइनों का स्राव करके और टी कोशिकाओं के विभाजन और शोथक्रिया में वृद्धि करती तथा वाहिकाप्रसरण व वाहिका पारगम्यता बढ़ाती हैं।[11][17] टी कोशिकाएं महाभक्षकों की गतिविधि में भी वृद्धि करती हैं।[11]
महाभक्षक[संपादित करें]
घाव के भरने के लिये महाभक्षक अत्यावश्यक होते हैं।[13] चोट लगने के दो दिनों के भीतर वे घाव में प्रमुख कोशिकाओं के रूप में पीएमएन (PMNs) का स्थान ले लेते हैं।[18] घाव-स्थल की ओर थक्का कोशिकाओं व अन्य कोशिकाओं द्वारा निर्गमित विकास कारकों द्वारा आकर्षित होकर रक्त प्रवाह में से मोनोसाइट रक्तवाहिकाभित्तियों के जरिये उस क्षेत्र में प्रवेश करते हैं।[19] घाव में मौजूद मोनोसाइटों की संख्या चोट लगने के एक से डेढ़ दिनों में अपने शीर्ष तक पहुंच जाती है।[17] घाव-स्थल पर एक बार पहुंचने के बाद, मोनोसाइट परिपक्व होकर महाभक्षकों में बदल जाते हैं। तिल्ली में शरीर के समस्त मोनोसाइटों की आधी मात्रा जख्मी ऊत्तक पर प्रयोग के लिये हमेशा तैयार रहती है।[20][21]
महाभक्षक की मुख्य भूमिका जीवाणुओं और क्षतिग्रस्त ऊत्तक का भक्षण करना होता है,[13] और वे प्रोटिएजों का निर्गम करके क्षतिग्रस्त ऊत्तक को हटाते भी हैं।[22] महाभक्षक विकास कारकों और अन्य साइटोकाइनों जैसे कई कारकों का स्राव भी करते हैं, विशेषकर घाव होने के बाद चौथे और पांचवे दिनों में. ये कारक मरम्मत की प्रफलन अवस्था में भाग लेने वाली कोशिकाओं को उस क्षेत्र की ओर आकर्षित करते हैं,[9] हालांकि संकुचित अवस्था में वे उन पर अंकुश लगा सकते हैं।[23] महाभक्षकों को उनके चारों ओर आक्सीजन की मात्रा में कमी द्वारा ऐसे कारकों का उत्पादन करने के लिये प्रेरित किया जाता है, जो रक्तवाहिकानिर्माण उत्प्रेरित करते और उसमें तेजी लाते हैं,[14] और वे ऐसी कोशिकाओं को भी उत्तेजित करते हैं, जो घाव का पुर्नउपर्त्वचीकरण, तथा कणांकुर ऊत्तक और नए बाह्यकोशिकीय आधात्रि का निर्माण करते हैं।[24][25] इन कारकों का स्राव करके महाभक्षक घाव की मरम्मत की प्रक्रिया को अगले चरण में ले जाने में योगदान करते हैं।
शोथकारी अवस्था का पतन[संपादित करें]
जैसे-जैसे शोथ-क्रिया खत्म होती है, शोथकारी कारकों के स्राव में कमी होने लगती है, पहले से मौजूद कारक का विघटन हो जाता है और घाव-स्थल पर न्यूट्रोफिलों और महाभक्षकों की संख्या कम हो जाती है।[13] ये परिवर्तन संकेत देते हैं कि शोथकारी अवस्था समाप्त हो रही है और प्रफलन अवस्था शुरू होने वाली है।[13] त्वचा के समान प्रतिमान का प्रयोग करके प्राप्त शरीर के बाहर प्राप्त सबूतों के अनुसार, महाभक्षकों की मौजूदगी वास्तव में घाव के संकुचन को धीमा कर सकती है और इसलिये घाव से महाभक्षकों का अदृश्य होना आगे की अवस्थाओं के होने के लिये आवश्यक हो सकता है।[26]
चूंकि शोथक्रिया संक्रमण से लड़ने, कचरे को हटाने और प्रफलन अवस्था को प्रेरित करने में भूमिकाएं निभाती है, यह घाव के सूखने का आवश्यक हिस्सा है। लेकिन, बहुत अधिक देर तक रहने पर शोथक्रिया के कारण ऊत्तक को क्षति पहुंच सकती है।[4] इस तरह उपचार के परिप्रेक्ष्य में शोथ में कमी लाना कई बार एक लक्ष्य होता है। शोथक्रिया तब तक रहती है जब तक घाव में अवशेष मौजूद होता है। इसलिये गंदगी या अन्य वस्तुओं की मौजूदगी शोथकारी अवस्था को बहुत समय तक बढ़ा सकती है, जिससे घाव पुराना हो जाता है।
प्रफलन अवस्था[संपादित करें]
घाव होने के दो या तीन दिनों बाद, तंतुकोशिकाएं घाव-स्थल में प्रवेश करने लगती हैं, जिससे शोथकारी अवस्था के समाप्त होने के पहले ही प्रफलन अवस्था शुरू हो जाती है।[27] घाव की मरम्मत की अन्य अवस्थाओं की तरह, प्रफलन अवस्था के चरण किसी श्रंखला में न होकर समय में आंशिक रूप से अतिव्यापी होते हैं।
रक्तवाहिकानिर्माण[संपादित करें]
रक्तवाहिकानिर्माण की प्रक्रिया, जिसे नववाहिकीकरण भी कहा जाता है, अंतर्कलीय कोशिकाओं के घाव के क्षेत्र में प्रवास करने पर तंतुकोशिकाओं के प्रफलन के साथ साथ-साथ होती है।[28] चूंकि तंतुकोशिकाओं और उपर्त्वचीय कोशिकाओं को आक्सीजन और पोषकों की आवश्यकता होती है, इसलिये घाव की मरम्मत की अन्य अवस्थाओं, जैसे उपर्त्वचीय व तंतुकोशिकाओं के प्रवास के लिये रक्तवाहिकानिर्माण आवश्यक है। जिस ऊत्तक में रक्तवाहिकानिर्माण होता है वह केशवाहिकाओं की उपस्थिति के कारण लाल (एरिथिमेटस) दिखाई देता है।[28]
अक्षतिग्रस्त रक्त वाहिकाओं के भागों से निकलने वाली अंतर्कलीय कोशिकाओं की स्टेम कोशिकाओं में नकली कोशिका प्रक्षेपण उत्पन्न हो जाते हैं और ईसीएम (ECM) में से घाव-स्थल में घुसकर नई रक्त वाहिकाओं का निर्माण करते हैं।[14]
अंतर्कलीय कोशिकाएं घाव के क्षेत्र की ओर फाइब्रिन पपड़ी पर पाए जाने वाले फाइब्रोनेक्टिन और अन्य कोशिकाओं द्वारा निर्गमित वाहिकाजनक कारकों द्वारा रासायनिक स्पर्श द्वारा आकर्षित की जाती हैं, उदा. कम-आक्सीजन के वातावरण में महाभक्षकों और थक्काकोशिकाओं द्वारा.[29] अंतर्कलीय विकास और प्रफलन भी आक्सीजन की अल्पता और घाव में लैक्टिक अम्ल की मौजूदगी द्वारा सीधे उत्तेजित होता है।[27]
प्रवास करने के लिये, अंतर्कलीय कोशिकाओं को थक्के और ईसीएम (ECM) के भाग को अवक्रमित करने के लिये कोलेजन और प्लास्मिनोजन उत्तेजक की जरूरत पड़ती है।[2][13] जस्ते पर निर्भर होने वाली मेटलोप्रोटिनेज कोशिका प्रवास, प्रफलन और रक्तवाहिकानिर्माण होने देने के लिये तलीय झिल्ली और ईसीएम (ECM) को पचा लेती हैं।[30]
जब महाभक्षक और अन्य विकास कारक-उत्पादक कोशिकाएं कम आक्सीजन वाले, लैक्टिक अम्ल भरे वातावरण से बाहर निकल आती हैं, तो वे वाहिकाजनक कारकों का उत्पादन बंद कर देती हैं।[14] इस प्रकार, जब ऊत्तक में पर्याप्त रूप से रक्त प्रवाह होने लगता है, अंतर्कलीय कोशिकाओं का प्रवास और प्रफलन कम हो जाता है। अंततोगत्वा, जिन रक्तवाहिकाओं की अब जरूरत नहीं होती है, वे स्वतःकोशिकामृत्यु द्वारा मर जाती हैं।[29]
तंतुविकास और कणांकुर ऊत्तक निर्माण[संपादित करें]
रक्तवाहिकानिर्माण के साथ ही, तंतुकोशिकाएं घाव स्थल पर एकत्रित होना शुरू कर देती हैं। तंतु कोशिकाएं घावस्थल में घाव होने के दो से पांच दिनों बाद, जब शोथकारी अवस्था समाप्त हो रही होती है, प्रवेश करना शुरू करती हैं और उनकी संख्या घाव होने के एक से दो हफ्तों बाद शीर्ष पर पहुंचती है।[13] पहले सप्ताह के अंत तक, तंतुकोशिकाएं घाव में मुख्य कोशिकाएं होती हैं।[2] तंतुविकसन घाव होने के दो से चार हफ्तों के बाद समाप्त होता है।
चोट लगने के बाद के पहले दो या तीन दिनों में, तंतुकोशिकाएं मुख्यतया प्रवास व प्रफलन करती हैं, जबकि बाद में, वे घाव स्थल में कोलेजन आधात्रि बनाने वाली मुख्य कोशिकाएं होती हैं।[2] इन तंतुकोशिकाओं की उत्पत्ति पास की अक्षतिग्रस्त त्वचा ऊत्तक से हुई मानी जाती है (हालांकि नए सबूतों के अनुसार इनमें से कुछ रक्त में प्रवाहित होने वाली वयस्क स्टेम कोशिकाओं/प्रीकर्सरों से उत्पन्न होती हैं)। [31] प्रारंभ में तंतुकोशिकाएं फाइब्रिन के पार-संयोजित तंतुओं (जो शोथकारी अवस्था के खत्म होने तक अच्छी तरह से बन चुके होते हैं) का प्रयोग घाव में प्रवास करने के लिये करती हैं और उसके बाद फाइब्रोनेक्टिन से चिपक जाती हैं।[29] तंतुकोशिकाएं फिर घाव की शय्या में मुख्य-पदार्थ और बाद में कोलेजन, जमा करती हैं, जिससे वे प्रवास के लिये चिपक सकती हैं।[9]
कणांकुर ऊत्तक अविकसित ऊत्तक की तरह कार्य करता है और जख्मी होने के दो से पांच दिनों बाद, घाव के शोथकारी अवस्था में रहने के समय ही प्रकट होने लगता है और घाव की शैय्या के भरने तक विकसित होता रहता है। कणांकुर ऊत्तक में नई रक्तवाहिकाएं, तंतुकोशिकाएं, शोथकारी कोशिकाएं, अंतर्कलीय कोशिकाएं, पेशीतंतुकोशिकाएं और नई कार्यकारी बाह्यकोशिकीय आधात्रि के अंश होते हैं। कार्यकारी ईसीएम (ECM) संरचना में सामान्य ऊत्तक की ईसीएम (ECM) से भिन्न होती है और इसके अंश तंतुकोशिकाओं में उत्पन्न होते हैं।[24] इन अंशों में फाइब्रोनेक्टिन, कोलेजन, ग्लाइकोअमाइनोग्लाइकॉन, इलेस्टिन, ग्लायकोप्रोटीन और प्रोटियोग्लायकॉन शामिल हैं।[29] इसके मुख्य अंश फाइब्रोनेक्टिन और हयालूरोनान होते हैं, जो एक अत्यंत जल-युक्त आधात्रि का निर्माण करते हैं तथा कोशिका-प्रवास में मदद करते हैं।[19] बाद में यह कार्यकारी आधात्रि एक ऐसी ईसीएम (ECM) द्वारा विस्थापित हो जाती है, जो अक्षतिग्रस्त ऊत्तक में पाई जाने वाली ईसीएम (ECM) से बहुत मिलती-जुलती होती है।
विकास कारक (पीडीजीएफ (PDGF), टीजीएफ-बीटा (TGF-β)) और फाइब्रोनेक्टिन तंतुकोशिकाओं द्वारा ईसीएम (ECM) अणुओं के प्रफलन, घाव की शैय्या की ओर प्रवास और उत्पादन को प्रोत्साहित करते हैं। तंतुकोशिकाएं उपर्त्वचीय कोशिकाओं को घाव-स्थल की ओर आकर्षित करने वाले विकास कारकों का स्राव भी करती हैं। आक्सीजन की कमी भी तंतुकोशिकाओं के प्रफलन और विकास कारकों के निकास में भाग लेती है, हालांकि, आक्सीजन की भीषण कमी उनके विकास और ईसीएम के अंशों के जमाव को रोक कर अत्यधिक, तंतुमय धब्बे उत्पन्न कर सकती है।
कोलेजन का संग्रह[संपादित करें]
तंतुकोशिकाओं के सबसे महत्वपूर्ण कार्यों में से एक कोलेजन का उत्पादन करना होता है।[28]
कोलेजन का जमाव आवश्यक होता है क्योंकि यह घाव की मजबूती को बढ़ाता है- इसके बनने के पहले घाव को बंद रखने वाली एकमात्र वस्तु फाइब्रिन-फाइब्रोनेक्टिन थक्का होता है, जो चोट से उत्पन्न होने वाले जख्म को अधिक प्रतिरोध उपलब्ध नहीं कराता.[14] साथ ही, शोथक्रिया, रक्तवाहिकानिर्माण और संयोजी ऊतक-निर्माण में लगी कोशिकाएं तंतुकोशिकाओं द्वारा निर्मित कोलेजन आधात्रि पर संलग्न होती, बढ़ती और विभेदित होती हैं।[32]
टाइप 3 कोलेजन और फाइब्रोनेक्टिन का अच्छी मात्रा में उत्पादन, मुख्यतः घाव के आकार के अनुसार, साधारणतया लगभग 10 घंटों[33] से 3 दिनों[29] के बीच होने लगता है। उनका जमाव एक से तीन हफ्तों में शीर्ष पर पहुंच जाता है।[24] परिपक्वता की अवस्था के अंत तक वे प्रमुख तननशील पदार्थ होते हैं, जिस समय उन्हें अधिक मजबूत टाइप 1 कोलेजन द्वारा विस्थापित कर दिया जाता है।
जिस समय तंतुकोशिकाएं नए कोलेजन का उत्पादन कर रही होती हैं, उसी समय कोलेजनेज़ और अन्य कारक उसे अवक्रमित भी करते जाते हैं। जख्म होने के थोड़ी देर बाद, अवक्रमण की तुलना में संश्लेषण अधिक होता है, जिससे घाव में कोलेजन के स्तर बढ़ जाते हैं, लेकिन बाद में उत्पादन और अवक्रमण समान हो जाते हैं जिससे कोलेजन में कुल लाभ शून्य रह जाता है।[14] यह समरूपता बाद की परिपक्वन अवस्था की शुरूआत का संकेत देती है। कणांकुरण धीरे से समाप्त हो जाता है और तंतुकोशिकाएं का संख्या घाव में एक बार उनका कार्य समाप्त हो जाने पर कम होने लगती है।[34] कणांकुरण अवस्था की समाप्ति पर, तंतुकोशिकाएं स्वतःकोशिकामृत्यु करना शुरू कर देती हैं, जिससे कणांकुर ऊत्तक कोशिकाओं से प्रचुर वातावरण से मुख्यतया कोलेजन से युक्त वातावरण में पहुंच जाता है।[2]
उपर्त्वचीकरण[संपादित करें]
खुले जख्म में कणांकुर ऊत्तक का निर्माण पुर्नउपर्त्वचीकरण अवस्था के होने में सहायक होता है, जिससे उपर्त्वचीय कोशिकाएं नए ऊत्तक में प्रवास करके घाव व वातावरण के बीच एक बांध का निर्माण करती हैं।[29] घाव के सिरों और त्वचा के अनुबंधों जैसे केश पुटिकाओं, स्वेद ग्रंथियों और सीबमयुक्त (तैल) ग्रंथियों की आधारभूत केरेटिन कोशिकाएं घाव की मरम्मत की उपर्त्वचीकरण अवस्था के लिये जिम्मेदार मुख्य कोशिकाएं हैं।[34] वे घाव-स्थल पर एक परत के रूप में फैलती हैं और उसके सिरों पर प्रफलित होती हैं तथा तभी रूकती हैं जब बीच में उनका मेल होता है।
केरेटिनकोशिकाएं पहले बिना प्रफलित हुए प्रवास करती हैं।[35] प्रवास जख्मी होने के कुछ ही घंटों में शुरू हो सकता है। लेकिन, प्रवास करने के लिये उपर्त्वचीय कोशिकाओं को जीवित ऊत्तक की आवश्यकता होती है, इसलिये यदि घाव गहरा हो तो उसे पहले कणांकुर ऊत्तक से भरा जाना चाहिये। [36] इस तरह से प्रवास के प्रारंभ का समय भिन्न हो सकता है और जख्मी होने के लगभग एक दिन बाद हो सकता है।[37] घाव के सिरों की कोशिकाएं जख्मी होने के बाद दूसरे और तीसरे दिन प्रफलित हो सकती हैं, ताकि प्रवास के लिये अधिक कोशिकाएं उपलब्ध हो सकें.[24]
यदि तलीय झिल्ली में व्यवधान न हुआ हो, तो उपर्त्वचीय कोशिकाएं तीन दिनों के भीतर आधारभूत पर्त (स्ट्रैटम बेसेल) में कोशिकाओं के विभाजन और ऊपर की ओर प्रवास द्वारा उसी तरह से विस्थापित हो जाती हैं जैसे अक्षतिग्रस्त त्वचा में होता है।[29] लेकिन यदि घाव-स्थल पर तलीय झिल्ली नष्ट हो जाए तो पुर्नउपर्त्वचीकरण घाव के सिरों और त्वचा के अनुबंधों जैसे केश पुटिकाओं व स्वेद और तैल ग्रंथियों से होना आवश्यक होता है, जो जीवित केरेटिनकोशिकाओं से सजी त्वचा में प्रवेश करती हैं।[24] यदि घाव बहुत गहरा हुआ तो त्वचा के अनुबंध भी नष्ट हो सकते हैं और तब प्रवास केवल घाव के सिरों से ही हो सकता है।[36]
घाव-स्थल पर केरेटिनकोशिकाओं का प्रवास संपर्क-अवरोध के अभाव और नाइट्रिक आक्साइड जैसे रसायनों द्वारा उत्तेजित होता है।[38] प्रवास करने के पहले, कोशिकाओं को अपने डेस्मोसोम और हेमीडेस्मोसोम का विघटन करना पड़ता है, जो सामान्यतया कोशिकाओं को माध्यमिक तंतुओं द्वारा उनके कोशिकापंजर में अन्य कोशिकाओं और ईसीएम (ECM) से बांधे रखते हैं।[17] इंटेग्रिन नामक पारझिल्ली रिसेप्टर प्रोटीन, जो ग्लायकोप्रोटीनों से बने होते हैं और सामान्यतया कोशिका को उसके कोशिकापंजर द्वारा तलीय झिल्ली से बांधे रखते हैं, कोशिका के माध्यमिक तंतुओं द्वारा निर्गमित किये जाते हैं और एक्टिन तंतुओं को प्रवास के समय विस्थापित करके नकली कोशिका सतह के लिये ईसीएम के संलग्नक की तरह काम में लाते हैं।[17] इस तरह केरेटिनकोशिकाएं तलीय झिल्ली से अलग हो जाती हैं और घाव की शैय्या में प्रवेश करने में सक्षम हो पाती हैं।[27]
प्रवास करने के पहले केरेटिनोकोशिकाएं अपने आकार को बदल लेती हैं और लंबी व सपाट होकर लेमेलीपोडिया जैसे कोशिकीय प्रवर्ध व झालर जैसे दिखने वाले चौड़े प्रवर्ध उत्पन्न कर लेती हैं।[19] एक्टिन तंतु और नकलीकोशिका भी बन जाते हैं।[27] प्रवास के समय, नकली कोशिकाओं के इंटेग्रिन ईसीएम (ECM) से जुड़ जाते हैं और प्रवर्ध के एक्टिन तंतु कोशिका को साथ खींच ले जाते हैं।[17] इंटेग्रिन के जरिये ईसीएम (ECM) में अणुओं की अंतर्क्रिया एक्टिन तंतुओं, लैमेलीपीडिया और फाइलोपोडिया के निर्माण को और बढ़ाती है।[17]
प्रवास करने के लिये उपर्त्वचीय कोशिकाएं एक दूसरे पर चढ़ जाती हैं।[34] उपर्त्वचीय कोशिकाओं की इस बढ़ती हुई परत को अकसर उपर्त्वचीय जिह्वा का नाम दिया जाता है।[35] तलीय झिल्ली से जुड़ने वाली पहली कोशिकाएं आधारभूत परत का निर्माण करती हैं। ये आधारभूत कोशिकाएं घाव-शैय्या के ऊपर प्रवास करती रहती हैं और उनके ऊपर की उपर्त्वचीय कोशिकाएं भी उनके साथ ही सरकती जाती हैं।[35] जितनी जल्दी यह प्रवास होता है, चोट का निशान उतना ही छोटा होता है।[39]
ईसीएम में फाइब्रिन, कोलेजन और फाइब्रोनेक्टिन आगे कोशिकाओं को विभाजित होने और प्रवास करने का संकेत दे सकते हैं। तंतुकोशिकाओं की तरह, प्रवासशील केरेटिनकोशिकाएं शोथक्रिया के समय जमा हुए फाइब्रिन के साथ पार-संयोजित हुए फाइब्रोनेक्टिन का प्रयोग रेंगकर आगे बढ़ने के लिये संयोजन स्थल के रूप में करती हैं।[19][22][34]
जैसे-जैसे केरेटिनकोशिकाएं प्रवास करती हैं, वे कणांकुर ऊत्तक से, लेकिन पपड़ी (यदि बन गई हो तो) के नीचे से बढ़ती हैं और उसे नीचे स्थित ऊत्तक से अलग करती हैं।[34][37] उपर्त्वचीय कोशिकाओं में व्यर्थ पदार्थ जैसे मृत ऊत्तक और जीवाणु पदार्थों का भक्षण करने की क्षमता होती है, जो अन्यथा उनका मार्ग अवरूद्ध कर सकता है। चूंकि उन्हें निर्मित हो रही किसी भी पपड़ी को घोल देना होता है, इसलिये केरेटिनोकोशिकाओं का प्रवास नम वातावरण द्वारा सबसे अच्छी तरह से बढ़ाया जाता है, क्योंकि शुष्क वातावरण में अधिक बड़ी और सख्त पपड़ी बनती है।[22][29][34][40] ऊत्तक में अपना रास्ता बनाने के लिये, केरेटिनकोशिकाओं द्वारा थक्के, कचरे और ईसीएम के भागों को विघटित करना आवश्यक है।[37][41] वे प्लाज्मिनोजन-उत्प्रेरक का स्राव करती हैं, जो प्लाज्मिनोजन को सक्रिय करता है और उसे पपड़ी को घोलने के लिये प्लाज्मिन में बदलता है। कोशिकाएं केवल जीवित ऊत्तक पर ही प्रवास कर सकती हैं[34], इसलिये उनका कोलेजनेजों और आधात्रि मेटेलोप्रोटीनेजों जैसे प्रोटिएजों का निकास करना आवश्यक होता है, ताकि वे अपने मार्ग में आने वाले ईसीएम (ECM) के क्षतिग्रस्त भागों को खत्म कर सकें, विशेषकर प्रवासशील परत के सामने.[37] केरेटिनकोशिकाएं तलीय झिल्ली को भी घोल देती हैं और उसकी बजाय रेंग कर बढ़ने के लिये तंतुकोशिकाओं द्वारा बनाई गई नई ईसीएम (ECM) का प्रयोग करती हैं।[17]
जैसे-जैसे केरेटिनकोशिकाएं प्रवास जारी रखती हैं, उनके स्थान पर घाव के सिरों पर नई उपर्त्वचीय कोशिकाओं का बनना आवश्यक होता है, जिससे आगे बढ़ती परत के लिये और अधिक कोशिकाएं उपलब्ध होती हैं।[22] प्रवासशील केरेटिनकोशिकाओं के पीछे प्रफलन सामान्यतः जख्मी होने के कुछ दिनों बाद शुरू होता है[36] और सामान्य ऊतकों के मुकाबले उसकी दर उपर्त्वचीकरण की इस अवस्था में 17 गुना अधिक होती है।[22] सारे जख्मी भाग के वापस बनने तक प्रफलित होने वाली उपर्त्वचीय कोशिकाएं केवल घाव के सिरों पर होती हैं।[35]
इंटेग्रिनों और एमएमपी द्वारा उत्तेजित विकास कारक कोशिकाओं को घाव के सिरों पर प्रफलित होने के लिये प्रोत्साहित करते हैं। स्वयं केरेटिनकोशिकाएं भी विकास कारकों और तलीय झिल्ली प्रोटीनों सहित कारकों का उत्पादन और स्राव करती हैं, जो उपर्त्वचीकरण और जख्म की मरम्मत की अन्य अवस्थाओं में मदद करते हैं।[42] विकास कारक न्यूनजीवाणुविरोधी पेप्टाइडों और केरेटिनकोशिकाओं में न्यूट्रोफिल कीमोटैक्टिक साइटोकाइनिनों के उत्पादन के प्रोत्साहन द्वारा त्वचा के घावों की आंतरिक प्रतिरोधी रक्षा के लिये भी महत्वपूर्ण होते हैं।[43]
केरेटिनकोशिकाएं घाव की शैय्या पर से तब तक प्रवास जारी रखती हैं, जब तक कि दोनों ओर की कोशिकाएं मध्य में मिल न जाएं, जिस समय संपर्क द्वारा अवरोध उन्हें प्रवास करने से रोक देता है।[19] जब वे प्रवास बंद कर देती हैं, तब केरेटिनकोशिकाएं उन प्रोटीनों का स्राव करती हैं जो नई तलीय झिल्ली का निर्माण करते हैं।[19] प्रवास शुरू करने के लिये धारण रूप के परिवर्तनों को कोशिकाएं उलटा कर देती हैं –वे पुनः डेस्मोसोम और हेमीडेस्मोसोम धारण कर लेती हैं और फिर एक बार तलीय झिल्ली से जुड़ जाती हैं।[17] आधारभूत कोशिकाएं पुर्नउपर्त्वचीय त्वचा में पाये जाने वाली पर्तों को पुर्नस्थापित करने के लिये उसी तरह से विभाजित और विभेदित होने लगती हैं जैसा कि वे सामान्य त्वचा में करती हैं।[19]
संकुचन[संपादित करें]
संकुचन घाव की मरम्मत की मुख्य अवस्था होती है। यदि संकुचन अधिक देर तक हुआ, तो उससे विकृति और कार्यक्षमता की हानि हो सकती है।[44] इसलिये घाव के संकुचन के जीवविज्ञान को समझने में काफी रूचि दिखाई गयी है, जिसे शरीर के बाहर कोलेजन जेल संकुचन जांच या त्वचीय समान प्रतिमान का प्रयोग करके प्रतिमानित किया जा सकता है।[26][45]
संकुचन जख्मी होने के लगभग एक हफ्ते बाद शुरू होता है, जब तंतुकोशिकाएं पेशीतंतुकोशिकाओं में विकसित होती हैं,[46] पूर्ण मोटाई वाले रोपणों में संकुचन जख्म होने के बाद 5 से 15 दिनों में अपने शीर्ष तक पहुंच जाता है।[29] संकुचन कई सप्ताहों तक होता रह सकता है[36] और घाव के पूरी तरह से पुर्नउपर्त्वचीकरण होने के बाद भी जारी रह सकता है।[2] कोई बड़ा जख्म संकुचन के बाद 40 से 80 प्रतिशत छोटा हो सकता है।[19][34] जख्मी भाग में ऊत्तक के ढीलेपन के अनुसार घाव 0.75 मिमी प्रतिदिन की गति तक से संकुचित हो सकते हैं।[29] संकुचन साधारणतया सममितीय तरीके से नहीं होता - बल्कि अधिकतर घावों के संकुचन का एक अक्ष होता है, जो कोशिकाओं को कोलेजन के साथ बेहतर संगठन और सम्मेलन करने देता है।[46]
पहले, संकुचन पेशीतंतुकोशिकाओं के बिना होता है।[47] बाद में विकास कारकों द्वारा उत्तेजित तंतुकोशिकाएं पेशीतंतुकोशिकाओं में बदल जाती हैं। पेशीतंतुकोशिकाएं जो चिकनी पेशी कोशिकाओं के समान होती हैं, संकुचन के लिये जिम्मेदार होती हैं।[47] पेशीतंतुकोशिकाओं में उसी तरह का एक्टिन होता है जैसा चिकनी पेशी कोशिकाओं में पाया जाता है।[44]
पेशीतंतुकोशिकाएं फाइब्रोनेक्टिन और विकास कारकों द्वारा आकर्षित होकर घाव के सिरों तक पहुंचने के लिये अस्थायी ईसीएम (ECM) में फाइब्रिन से जुड़े फाइब्रोनेक्टिन के सहारे आगे बढ़ती हैं।[22] वे घाव के सिरों पर ईसीएम से संपर्क बनाती हैं और आपस में तथा घाव के सिरों से डेस्मोसोमों द्वारा जुड़ती हैं। साथ ही, फाइब्रोनेक्सस नामक एक अवलम्ब पर पेशीतंतुकोशिका का एक्टिन कोशिका झिल्ली के पार बाह्यकोशिका आधात्रि के अणुओं जैसे फाइब्रोनेक्टिन और कोलेजन से जुड़ जाता है।[47] पेशीतंतुकोशिकाओं के ऐसे कई अवलम्ब हो सकते हैं, जो संकुचन के समय उन्हें ईसीएम (ECM) को खींचने देते हैं, जिससे घाव का आकार छोटा हो जाता है।[44] संकुचन के इस भाग में, गैरपेशीतंतुकोशिका वाले पहले भाग की अपेक्षा अधिक तेजी से घाव बंद होता है।[47]
जैसे-जैसे पेशीतंतुकोशिकाओं में एक्टिन संकुचित होता है, घाव के सिरे खिंचते जाते हैं। पेशीतंतुकोशिकाओं के संकुचन के साथ, घाव को मजबूत बनाने के लिये तंतुकोशिकाएं कोलेजन बिछाती जाती हैं।[2] प्रफलन में संकुचन का चरण पेशीतंतुकोशिकाओं के संकुचन बंद करने और स्वतःकोशिकामृत्यु कर लेने के साथ समाप्त हो जाता है।[44] अस्थायी आधात्रि के विघटन से हयालूरोनिक एसिड में कमी और कांड्राइटिन सल्फेट में वृद्धि होती है, जो धीर-धीरे तंतुकोशिकाओं के प्रवास और प्रफलन को रोक देता है।[13] ये घटनाएं घाव भरने की परिपक्वन अवस्था का संकेत होती हैं।
परिपक्वन और पुर्ननिर्माण[संपादित करें]
जब कोलेजन उत्पादन और अवक्रमण के स्तर समान हो जाते हैं, तब ऊत्तक की मरम्मत की परिपक्वन दशा का प्रारंभ हो जाना माना जाता है।[14] परिपक्वन के समय, टाइप 3 कोलेजन, जो प्रफलन के समय प्रमुखता लेती है, धीरे-धीरे अवक्रमित होने लगती है और उसके स्थान पर अधिक मजबूत टाइप 1 कोलेजन बिछाई जाती है।[11] मूल रूप से विसंघटित कोलेजन तंतु पुर्नव्यवस्थित और पार-संयोजित होकर तनाव रेखाओं के साथ-साथ जमा दिये जाते है।[19] परिपक्वन अवस्था का प्रारंभ घाव के आकार और शुरू में उसके बंद किये जाने या खुला छोड़ दिये जाने के अनुसार बड़ा भिन्न हो सकता है,[24] और यह करीब 3 दिनों[33] से 3 हफ्तों[48] तक में हो सकता है। इसी तरह, परिपक्वन अवस्था घाव के प्रकार के अनुसार एक वर्ष या उससे अधिक समय तक जारी रह सकती है।[24]
जैसे-जैसे यह अवस्था आगे बढ़ती है, घाव की तनन शक्ति बढ़ती है, जो चोट लगने के बाद तीन महीनों में सामान्य ऊत्तक की ताकत के 50 प्रतिशत तक और अंततः उसके 80 प्रतिशत तक शक्तिशाली हो जाती है।[24] चूंकि घाव-स्थल पर गतिविधि कम हो जाती है, घाव का निशान अपनी लालिमा छोड़ देता है, क्योंकि रक्त वाहिकाओं की अब जरूरत न होने के कारण उन्हें स्वतःकोशिकामृत्यु द्वारा हटा लिया जाता है।[14]
घाव की मरम्मत के चरण सामान्यतया पूर्वानुमान योग्य, सामयिक तरीके से होते हैं –यदि ऐसा न हो तो मरम्मत अनुचित रूप से होकर दीर्घकालिक जख्म[4] जैसे शिरा के वृण या रोगजन्य निशान जैसे कीलायड दाग में बदल सकती है।[49][50]
शोध और विकास[संपादित करें]
एक दशक पहले तक, घाव की मरम्मत के आदर्श उदाहरण, जिसमें अवयव-विशिष्ट वंशावलियों तक सीमित स्टेम कोशिकाओं की भागीदारी मानी जाती है, को कभी गंभीरता से चुनौती नहीं दी गई थी। तब से, वयस्क स्टेम कोशिकाओं के कोशिकीय लचक से युक्त होने या गैर-वंशावली वाली कोशिकाओं में विकसित होने की क्षमता का विचार एक वैकल्पिक व्याख्या के रूप में उभरा है।[1] अधिक स्पष्ट रूप से कहें तो, रक्तनिर्माण प्रजनक कोशिकाओं (जो रक्त में परिपक्व कोशिकाओं को जन्म देती हैं) में वि-विभेदीकरण द्वारा रक्तनिर्माण स्टेम कोशिकाओं में वापस बदलने और/या गैर-वंशावली कोशिकाओं, जैसे तंतुकोशिकाओं, में परिविभेदित होने की क्षमता हो सकती है।[31]
स्टेम कोशिकाएं और कोशिकीय लचक[संपादित करें]
बहुसक्षम वयस्क स्टेम कोशिकाओं में स्वतःनवीकरण और विभिन्न कोशिका प्रकार उत्पन्न करने की क्षमता होती है। स्टेम कोशिकाएं प्रजनक कोशिकाओं को उत्पन्न करती हैं, जो स्वतःनवीकरण तो नहीं कर सकतीं, परंतु कई तरह की कोशिकाएं उत्पन्न कर सकती हैं। त्वचा के घाव की मरम्मत में स्टेम कोशिकाओं की भागीदारी की सीमा पेचीदा है और पूरी तरह से समझी नहीं गई है।
यह समझा जाता है कि उपर्कला और त्वचा सूत्रीविभाजन रूप से सक्रिय स्टेम कोशिकाओं दवारा पुर्नगठित की जाती हैं, जो रेटी के उभारों (आधारभूत स्टेम कोशिकाए) के शीर्ष पर, केश पुटिकाओं के उभारों (केश पुटिकीय स्टेम कोशिका) पर और प्रवर्धी त्वचा (त्वचीय स्टेम कोशिकाएं) पर निवास करती हैं।[1] इसके अलावा, अस्थि मज्जा में भी त्वचा के घावों की मरम्मत में मुख्य भूमिका निभाने वाली स्टेम कोशिकाएं हो सकती हैं।[31]
दुर्लभ परिस्थितियों में, जैसे त्वचा के व्यापक रूप से जख्मी होने पर, अस्थि मज्जा की स्वतःनवीकरण उपआबादियां मरम्मत की प्रक्रिया में भाग लेने के लिये प्रेरित की जा सकती हैं, जहां वे कोलेजन-स्रावक कोशिकाओं को उत्पन्न करती हैं, जो घाव की मरम्मत में भूमिका निभाती लगती हैं।[1] ये दो स्वतःनवीकरण उपआबादियां हैं, (1) अस्थि मज्जा से उत्पन्न मेसेन्काइमल स्टेम कोशिकाएं (एमएससी (MSC)) और (2) रक्तनिर्माण प्रजनक कोशिकाएं (एचएससी (HSC))। अस्थि मज्जा में एक प्रजनक उपआबादी (अंतर्कलीय प्रजनक कोशिकाएं या ईपीसी (EPC)) भी निवास करती है जो समान परिस्थिति में रक्त वाहिकाओं की पुर्नसंरचना में मदद के काम में लाई जाती हैं।[31] साथ ही, यह समझा जाता है कि, त्वचा को लगी व्यापक चोट जख्मी भाग पर श्वेताणुओं (प्रवाही तंतुकोशिकाएं) के एक अनोखे उपवर्ग को भी शीघ्र पहुंचने के लिये प्रेरित करती है, जहां वे घाव की मरम्मत से संबंधित विभिन्न कार्य करते हैं।[1]
घाव की मरम्मत बनाम पुर्नउत्पत्ति[संपादित करें]
'मरम्मत' और 'पुर्नउत्पत्ति' के बीच एक हल्का सा अंतर होता है।[1] किसी भी ऊत्तक के रूप और/या कार्यक्षमता में व्यवधान को चोट कहते हैं। मरम्मत का संबंध चोट लगने के बाद खोए गए या क्षतिग्रस्त ऊत्तक के संपूर्ण पुर्नस्थापन के बिना तारतम्य पुर्नस्थापित करने के प्रयत्न में अवयव के शरीरक्रियात्मक अनुकूलन से होता है। शाश्वत ऊत्तक पुर्नउत्पत्ति का मतलब खोए या क्षतिग्रस्त हुए ऊत्तक की बिल्कुल वैसी ही नकल का पुर्नस्थापन करने से है, जिसमें रूप और कार्यक्षमता दोनों ही पूरी तरह से पुर्नस्थापित हो जाते हैं। स्तनधारियों स्वैच्छिक पुर्नउत्पति नहीं करते है। कुछ स्थितियों में जैसे त्वचा में आंशिक पुर्नउत्पत्ति जैवअवक्रमणीय (कोलेजन-ग्लायकोअमाइनोग्लायकान) मचानों के प्रयोग द्वारा उत्प्रेरित की जा सकती है। ये मचान रचनात्मक रूप से सामान्य/गैर-जख्मी त्वचा में पाई जाने वाली बाह्यकोशिकीय आधात्रि (ईसीएम (ECM)) के सदृश होते हैं।[51] मजे की बात यह है कि, ऊत्तक के पुर्ननिर्माण के लिये आवश्यक मूलभूत दशाएं अकसर ऐसी दशाओं के विरूद्ध होती हैं, जो घाव की सुघड़ मरम्मत के लिये उपयुक्त होती हैं, जिनमें (1) थक्काकोशिकाओं के सक्रियीकरण का अवरोध, (2) शोथकारी प्रतिक्रिया और (3) घाव का संकुचन शामिल है।[1] तंतुकोशिका और अंतर्कलीय कोशिका के बंधन के लिये समर्थन देने के अलावा, जैवअवक्रमणीय मचान घाव के संकुचन को अवरूद्ध करते हैं, जिससे मरम्मत की प्रक्रिया अधिक पुर्ननिर्माण/कम निशान वाले पथमार्ग पर अग्रसर होती है।
प्रकार[संपादित करें]
प्राथमिक प्रयोजन[संपादित करें]
त्वचा को पूरी तरह से भेदे बिना उपर्त्वचा और त्वचा का योगदान. उपर्त्वचीकरण की प्रक्रिया द्वारा घाव की मरम्मत
- जब घाव के सिरे पास लाए जाते हैं ताकि वे एक-दूसरे के पास-पास रहें (पुर्ननिकटन)
- न्यूनतम धब्बा बनता है
- अधिकांश शल्यचिकित्सा के घाव प्राथमिक प्रयोजन की मरम्मत से ठीक होते हैं
- घाव को टांकों, स्टेपलों, या चिपकने वाले टेप से बंद किया जाता है
- उदा. अच्छी तरह से मरम्मत किये गए घाव, पुर्नस्थापित अस्थिभंगुरता, फ्लैप सर्जरी के बाद मरम्मत
द्वितीयक प्रयोजन[संपादित करें]
- जख्म को कणांकुरित होने दिया जाता है
- सर्जन घाव को पट्टी से भर सकता है या निकास प्रणाली का प्रयोग कर सकता है
- कणांकुरण के कारण बड़ा दाग बनता है
- ठीक होने की प्रक्रिया संक्रमण से उत्पन्न निकास की मौजूदगी के कारण धीमी हो सकती है
- घाव की सुश्रूषा रोज करनी पड़ती है ताकि घाव से कचरे की सफाई करके कणांकुर ऊत्तक के निर्माण में सहायता मिले
- उदा. जिंजिवेक्टमी, जिंजिवोप्लास्टी, दांत निकालने के सॉकेट, गलत तरीके से उपचार की गई अस्थिभंगुरताएं.
तृतीयक प्रयोजन[संपादित करें]
(विलंबित प्राथमिक बंदीकरण या द्वितीयक टांकाकरण):
- घाव को बंद करने के 4 से 5 दिन पहले साफ किया जाता, साफ किया और अवलोकित किया जाता है।
- घाव को जानबूझ कर खुला रखा जाता है।
- उदा.ऊत्तक रोपणों द्वारा घावों का उपचार
भाग लेने वाले विकास कारकों का सिंहावलोकन[संपादित करें]
घाव के सूखने में भागीदार मुख्य विकास कारक निम्न हैं -
| विकास कारक | संक्षिप्त नाम | मुख्य मूल | प्रभाव |
|---|---|---|---|
| उपर्त्वचा विकास कारक | ईजीएफ (EGF) |
|
|
| ट्रांसफार्मिंग विकासकारक-अल्फा | टीजीएफ-अल्फा (TGF-α) |
|
|
| यकृतकोशिका विकास कारक | एचजीएफ (HGF) |
|
|
| वाहिकीय अंतर्कलीय विकास कारक | वीईजीएफ (VEGF) |
|
|
| थक्काकोशिकाएं-प्राप्य विकास कारक | पीडीजीएफ (PDGF) |
|
|
| तंतुकोशिका विकास कारक 1 और 2 | एफजीएफ (FGF)-1, -2 |
|
|
| ट्रांसफार्मिंग विकास कारक-बीटा | टीजीएफ-बीटा (TGF-β) |
|
|
| केरेटिनकोशिकाएं विकास कारक | केजीएफ (KGF) |
|
|
| जब तक किसी बक्से में निर्दिष्ट है, तो संदर्भ है:[52] | |||
सन्दर्भ[संपादित करें]
- ↑ अ आ इ ई उ ऊ ए ऐ ओ औ क गुयेन, डी.टी., ओर्गिल डी.पी., मर्फी जी.एफ. (2009). अध्याय 4: घाव भरने और त्वचीय उत्थान के लिए पैथोफिज़ियोलॉजिक आधार. नुकसान त्वचा के उपचार के लिए बायोमैटिरियल्स. सीआरसी (CRC) प्रेस (अमेरिका) और वूडहेड प्रकाशन (यूके/यूरोप), बोका रैटन/कैम्ब्रिज, पृष्ठ. 25-57. (ISBN 978-1-4200-9989-9, ISBN 978-1-84569-363-3)
- ↑ अ आ इ ई उ ऊ ए ऐ ओ औ क ख ग Stadelmann, WK; Digenis, AG; Tobin, GR (1998). "Physiology and healing dynamics of chronic cutaneous wounds". American journal of surgery. 176 (2A Suppl): 26S–38S. PMID 9777970. डीओआइ:10.1016/S0002-9610(98)00183-4.
- ↑ कुइन, जे.वी. (1998). टिशु अड्हेसिव इन वुंड केयर. हैमिल्टन, ओंट. बी.सी. डेकर, इंक. इलेक्ट्रॉनिक किताब.
- ↑ अ आ इ ई उ ऊ ए ऐ Midwood, K.S.; Williams, L.V.; Schwarzbauer, J.E. (2004). "Tissue repair and the dynamics of the extracellular matrix". The International Journal of Biochemistry & Cell Biology. 36 (6): 1031–1037. PMID 15094118. डीओआइ:10.1016/j.biocel.2003.12.003.
- ↑ Chang, HY; Sneddon, JB; Alizadeh, AA; Sood, R; West, RB; Montgomery, K; Chi, JT; Van De Rijn, M; Botstein, D (2004). "Gene expression signature of fibroblast serum response predicts human cancer progression: similarities between tumors and wounds". PLoS biology. 2 (2): E7. PMID 14737219. डीओआइ:10.1371/journal.pbio.0020007. पी॰एम॰सी॰ 314300. मूल से 28 फ़रवरी 2008 को पुरालेखित. अभिगमन तिथि 14 जून 2020.
- ↑ गार्ग, एच.जी. (2000). स्केरलेस वुंड हीलिंग. न्यूयॉर्क मार्सेल डेकर, इंक. इलेक्ट्रॉनिक किताब.
- ↑ इनोक, एस. प्राइस, पी. (2004). सेलुलर, मॉलिक्यूलर एंड बायो केमिकल डिफरेंसेस इन द पैथोफिज़ियोलॉजी ऑफ़ हीलिंग बिटविन अक्युट वुंड्स, क्रोनिक वुंड्स इन द एल्डर्ली. Worldwidewounds.com.
- ↑ संदर्भ सूची मुख्य पृष्ठ के चित्र पर उपलब्ध है।
- ↑ अ आ इ ई उ रोसेंबर्ग एल., डी ला टोरे जे. (2006). वुंड हीलिंग, ग्रोथ फैक्टर्स. Archived 2008-11-21 at the वेबैक मशीन Emedicine.com. 20 जनवरी 2008 को अभिगम.
- ↑ Sandeman, S.R.; Allen, M.C.; Liu, C.; Faragher, R.G.A.; Lloyd, A.W. (2000). "Human keratocyte migration into collagen gels declines with in vitro ageing". Mechanisms of Ageing and Development. 119 (3): 149–157. PMID 11080534. डीओआइ:10.1016/S0047-6374(00)00177-9.
- ↑ अ आ इ ई डिली सी. (1999). द केयर ऑफ़ वुंड्स: अ गाइड फॉर नर्स. ऑक्सफोर्ड; मैल्डेन, मास. ब्लैकवेल विज्ञान. इलेक्ट्रॉनिक किताब.
- ↑ Theoret, C.L. (2004). "Update on wound repair". Clinical Techniques in Equine Practice. 3 (2): 110–122. डीओआइ:10.1053/j.ctep.2004.08.009.
- ↑ अ आ इ ई उ ऊ ए ऐ डे ला टोरे, जे., शोलर ए. (2006). वुंड हीलिंग: क्रोनिक वुंड्स. Archived 2008-10-29 at the वेबैक मशीन Emedicine.com. 20 जनवरी 2008 को अभिगम.
- ↑ अ आ इ ई उ ऊ ए ऐ Greenhalgh, D.G. (1998). "The role of apoptosis in wound healing". The International Journal of Biochemistry & Cell Biology. 30 (9): 1019–1030. PMID 9785465. डीओआइ:10.1016/S1357-2725(98)00058-2.
- ↑ Muller, M.J.; Hollyoak, M.A.; Moaveni, Z.; La, T.; Brown, H.; Herndon, D.N.; Heggers, J.P. (2003). "Retardation of wound healing by silver sulfadiazine is reversed by Aloe vera and nystatin". Burns. 29 (8): 834–836. PMID 14636760. डीओआइ:10.1016/S0305-4179(03)00198-0.
- ↑ Martin, P.; Leibovich, SJ (2005). "Inflammatory cells during wound repair: the good, the bad and the ugly". Trends in Cell Biology. 15 (11): 599–607. PMID 16202600. डीओआइ:10.1016/j.tcb.2005.09.002.
- ↑ अ आ इ ई उ ऊ ए ऐ Santoro, M.M.; Gaudino, G. (2005). "Cellular and molecular facets of keratinocyte reepithelization during wound healing". Experimental Cell Research. 304 (1): 274–286. PMID 15707592. डीओआइ:10.1016/j.yexcr.2004.10.033.
- ↑ आण्विक चिकित्सा में विशेषज्ञ समीक्षाएं. (2003)[1] Archived 2008-12-17 at the वेबैक मशीन.द फेसेस ऑफ़ क्युटैनियस वुंड हीलिंग. Archived 2008-12-17 at the वेबैक मशीन 5 : 1. कैम्ब्रिज युनिवर्सिटी प्रेस. 20 जनवरी 2008 को अभिगम.
- ↑ अ आ इ ई उ ऊ ए ऐ ओ लोरेन्ज एच.पी. और लोंगेकर एम.टी. (2003). घाव: जीवविज्ञान, पैथोलॉजी और प्रबंधन. Archived 2014-08-24 at the वेबैक मशीन स्टैनफोर्ड यूनिवर्सिटी मेडिकल सेंटर. 20 जनवरी 2008 को अभिगम.
- ↑ Swirski, F. K.; Nahrendorf, M.; Etzrodt, M.; Wildgruber, M.; Cortez-Retamozo, V.; Panizzi, P.; Figueiredo, J.-L.; Kohler, R. H.; Chudnovskiy, A. (2009). "Identification of Splenic Reservoir Monocytes and Their Deployment to Inflammatory Sites". Science. 325 (5940): 612–616. PMID 19644120. डीओआइ:10.1126/science.1175202. पी॰एम॰सी॰ 2803111.
- ↑ Jia, T.; Pamer, E. G. (2009). "Dispensable But Not Irrelevant". Science. 325 (5940): 549–550. PMID 19644100. डीओआइ:10.1126/science.1178329. पी॰एम॰सी॰ 2917045.
- ↑ अ आ इ ई उ ऊ Deodhar, AK; Rana, RE (4/1/1997). "Surgical physiology of wound healing: a review". Journal of Postgraduate Medicine. 43 (2): 52. PMID 10740722. मूल से 12 जनवरी 2019 को पुरालेखित. अभिगमन तिथि 24 जनवरी 2011.
|date=में तिथि प्राचल का मान जाँचें (मदद) - ↑ Newton, P. M.; Watson, J. A.; Wolowacz, R. G.; Wood, E. J. (2004). "Macrophages Restrain Contraction of an In Vitro Wound Healing Model". Inflammation. 28 (4): 207. PMID 15673162. डीओआइ:10.1023/B:IFLA.0000049045.41784.59. मूल से 8 दिसंबर 2012 को पुरालेखित. अभिगमन तिथि 24 जनवरी 2011.
- ↑ अ आ इ ई उ ऊ ए ऐ मर्सेंडेटी एम., ए.जे. (2005). घाव आरोग्यकर: चिकित्सा और मरम्मत Archived 2008-11-21 at the वेबैक मशीन. Emedicine.com. 20 जनवरी 2008 को अभिगम.
- ↑ Stashak, T.S.; Farstvedt, E.; Othic, A. (2004). "Update on wound dressings: Indications and best use". Clinical Techniques in Equine Practice. 3 (2): 148–163. डीओआइ:10.1053/j.ctep.2004.08.006.
- ↑ अ आ Newton, P. M.; Watson, J. A.; Wolowacz, R. G.; Wood, E. J. (2004). "Macrophages Restrain Contraction of an In Vitro Wound Healing Model". Inflammation. 28 (4): 207. PMID 15673162. डीओआइ:10.1023/B:IFLA.0000049045.41784.59. मूल से 8 दिसंबर 2012 को पुरालेखित. अभिगमन तिथि 24 जनवरी 2011.
- ↑ अ आ इ ई फलंगा वी. (2005). घाव आरोग्यकर. त्वचा विज्ञान के अमेरिकी अकादमी (एएडी (AAD)).
- ↑ अ आ इ कुवाहरा आर.टी. और रसबेरी आर. 2007. रासायनिक पिल्स Archived 2008-10-25 at the वेबैक मशीन. Emedicine.com. 15 सितंबर 2007 को अभिगम.
- ↑ अ आ इ ई उ ऊ ए ऐ ओ औ रोमो टी. और पीयर्सन जे.एम. 2005. घाव आरोग्यकर, त्वचा Archived 2008-12-07 at the वेबैक मशीन. Emedicine.com. 27 दिसम्बर 2006 को अभिगम.
- ↑ Lansdown, A.B.G.; Sampson, B.; Rowe, A. (2001). "Experimental observations in the rat on the influence of cadmium on skin wound repair". International Journal of Experimental Pathology. 82 (1): 35–41. PMID 11422539. डीओआइ:10.1046/j.1365-2613.2001.00180.x.
- ↑ अ आ इ ई Song, G; Nguyen, DT; Pietramaggiori, G; Scherer, S; Chen, B; Zhan, Q; Ogawa, R; Yannas, IV; Wagers, AJ (2010). "Use of the parabiotic model in studies of cutaneous wound healing to define the participation of circulating cells". Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 18 (4): 426–432. PMID 20546556. डीओआइ:10.1111/j.1524-475X.2010.00595.x. पी॰एम॰सी॰ 2935287.
- ↑ Ruszczak, Z. (2003). "Effect of collagen matrices on dermal wound healing". Advanced Drug Delivery Reviews. 55 (12): 1595–1611. PMID 14623403. डीओआइ:10.1016/j.addr.2003.08.003.
- ↑ अ आ आकार. 9-1. घाव आरोग्यकर के सेलुलर, जैव रासायनिक, यांत्रिक चरण. Pollock, Raphael E.; F. Charles Brunicardi; Dana Lynne Andersen; Billiar, Timothy R.; Dunn, David; Hunter, John G.; Matthews, Jeffrey J. (2009). Schwartz's Principles of Surgery, Ninth Edition. McGraw-Hill Professional. आई॰ऍस॰बी॰ऍन॰ 0-07-154769-X.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ अ आ इ ई उ ऊ ए ऐ डीपिट्रो एल.ए. और बर्न्स ए.एल., एड्स. 2003. घाव आरोग्यकर: तरीके और प्रोटोकॉल. आणविक दवा में तरीके. टोटोवा, एन.जे. हुमाना प्रेस. किताब इलेक्ट्रॉनिक.
- ↑ अ आ इ ई Bartkova, J.; Grøn, B.; Dabelsteen, E.; Bartek, J. (2003). "Cell-cycle regulatory proteins in human wound healing". Archives of Oral Biology. 48 (2): 125–132. PMID 12642231. डीओआइ:10.1016/S0003-9969(02)00202-9.
- ↑ अ आ इ ई मलवानी एम. और हैरिंगटन ए. 1994. Chapter 7: क्युटैनियस ट्रॉमा एंड इट्स ट्रीटमेंट. इन, टेक्स्टबुक ऑफ़ मिलिट्री मेडिसिन: मिलिट्री डर्माटोलॉजी . सर्जन जनरल, सेना विभाग के कार्यालय. आभासी नौसेना अस्पताल परियोजना. 15 सितंबर 2007 पर वेब संग्रह के माध्यम से अभिगामित.
- ↑ अ आ इ ई लर्जावा एच., कोइविस्टो एल. और हैकिनेन एल. 2002. अध्याय 3: घाव आरोग्यकर के दौरान फाइबरोनेक्टिन के साथ केराटिनोसाइट सहभागिता. इन, हीनो, जे. और कहारी, वी.एम. सेल आक्रमण . मेडिकल इंटेलिजेंस यूनिट; 33. जॉर्जटाउन, टेक्स, ऑस्टिन, टेक्स लैंडेस बायोसाइंस, इंक. इलेक्ट्रॉनिक किताब.
- ↑ Witte, M.B.; Barbul, A. (2002). "Role of nitric oxide in wound repair". The American Journal of Surgery. 183 (4): 406–412. PMID 11975928. डीओआइ:10.1016/S0002-9610(02)00815-2.
- ↑ Son, H.J. Bae H.C.; Kim, H.J.; Lee, D.H.; Han, D.W.; Park, J.C.; Park, J (2005). "Effects of β-glucan on proliferation and migration of fibroblasts". Current Applied Physics. 5 (5): 468–471. डीओआइ:10.1016/j.cap.2005.01.011.
- ↑ Falanga, V. (2004). "The chronic wound: impaired healing and solutions in the context of wound bed preparation". Blood Cells, Molecules, and Diseases. 32 (1): 88–94. PMID 14757419. डीओआइ:10.1016/j.bcmd.2003.09.020.
- ↑ Etscheid, M.; Beer, N.; Dodt, J. (2005). "The hyaluronan-binding protease upregulates ERK1/2 and PI3K/Akt signalling pathways in fibroblasts and stimulates cell proliferation and migration". Cellular Signalling. 17 (12): 1486–1494. PMID 16153533. डीओआइ:10.1016/j.cellsig.2005.03.007.
- ↑ Bayram, Y; Deveci, M; Imirzalioglu, N; Soysal, Y; Sengezer, M (2005). "The cell based dressing with living allogenic keratinocytes in the treatment of foot ulcers: a case study". British journal of plastic surgery. 58 (7): 988–96. PMID 16040019. डीओआइ:10.1016/j.bjps.2005.04.031.
- ↑ Sørensen, OE; Thapa, DR; Roupé, KM; Valore, EV; Sjöbring, U; Roberts, AA; Schmidtchen, A; Ganz, T (2006). "Injury-induced innate immune response in human skin mediated by transactivation of the epidermal growth factor receptor". The Journal of clinical investigation. 116 (7): 1878–85. PMID 16778986. डीओआइ:10.1172/JCI28422. पी॰एम॰सी॰ 1479426.
- ↑ अ आ इ ई Hinz, B (2006). "Masters and servants of the force: the role of matrix adhesions in myofibroblast force perception and transmission". European journal of cell biology. 85 (3–4): 175–81. PMID 16546559. डीओआइ:10.1016/j.ejcb.2005.09.004.
- ↑ Grinnell, F. (1994). "Fibroblasts, myofibroblasts, and wound contraction". J. Cell Biol. 124 (4): 401–404. PMID 8106541. डीओआइ:10.1083/jcb.124.4.401. पी॰एम॰सी॰ 2119916.
- ↑ अ आ Eichler, MJ; Carlson, MA (2006). "Modeling dermal granulation tissue with the linear fibroblast-populated collagen matrix: a comparison with the round matrix model". Journal of dermatological science. 41 (2): 97–108. PMID 16226016. डीओआइ:10.1016/j.jdermsci.2005.09.002.
- ↑ अ आ इ ई Mirastschijski, U.; Haaksma, C.J.; Tomasek, J.J.; Ågren, M.S. (2004). "Matrix metalloproteinase inhibitor GM 6001 attenuates keratinocyte migration, contraction and myofibroblast formation in skin wounds". Experimental Cell Research. 299 (2): 465–475. PMID 15350544. डीओआइ:10.1016/j.yexcr.2004.06.007.
- ↑ ग्रेगरी एस स्कुल्ट्ज़, ग्लेन लैडविग और एनेट विसोकी द्वारा worldwidewounds.com Archived 2011-07-05 at the वेबैक मशीन > आकार 3 - द टाइम रिलेशनशिप बिटविन द डिफरेंट प्रोसेसेस ऑफ़ वुंड हीलिंग Archived 2011-07-18 at the वेबैक मशीन - एस्मुसेन पीडी, सोलनेर बी. से अनुकूलित. वुंड हीलिंग के प्रक्रिया. इन: वुंड केयर. ट्यूटोरियल चिकित्सा सीरीज. स्टुटगार्ट: हिप्पोक्रेट्स वर्लग, 1993.
- ↑ O'Leary, R; Wood, EJ; Guillou, PJ (2002). "Pathological scarring: strategic interventions". The European journal of surgery = Acta chirurgica. 168 (10): 523–34. PMID 12666691.
- ↑ Desmouliere, A.; Chaponnier, C.; Gabbiani, G. (2005). "Tissue repair, contraction, and the myofibroblast". Wound Repair and Regeneration. 3 (1): 7–12. PMID 15659031. डीओआइ:10.1111/j.1067-1927.2005.130102.x.
- ↑ Yannas, I. V. (1989). "Synthesis and Characterization of a Model Extracellular Matrix that Induces Partial Regeneration of Adult Mammalian Skin" (PDF). Proceedings of the National Academy of Sciences. 86: 933–937. डीओआइ:10.1073/pnas.86.3.933. पी॰एम॰सी॰ 286593.[मृत कड़ियाँ]
- ↑ तालिका 3-1 में: Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson (2007). Robbins Basic Pathology. Philadelphia: Saunders. आई॰ऍस॰बी॰ऍन॰ 1-4160-2973-7.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) 8 संस्करण.
बाहरी कड़ियाँ[संपादित करें]
- ओर्गिल डी.पी.[2]घाव भरने और ऊत्तक इंजीनियरिंग प्रयोगशाला हार्वर्ड मेडिकल स्कूल, ब्रिघम और महिलाओं के अस्पताल.
- इन्ग्बेर डी. कैसे घाव ठीक और ट्यूमर फार्म कैसे होते हैं बच्चों के अस्पताल के बोस्टन अनुसंधान विभाग.
- मुस्टो टी. 2005. त्वचीय अल्सर चिकित्सा: एड्वांसेस इन अंडरस्टैंडिंग. प्रेज़ेन्टेड एट मीटिंग: टिशु रिपेर एंड अल्सर/वुंड हीलिंग: मॉलिक्यूलर मेकैनिज्म, थेराप्युटिक टारगेट्स एंड फ्यूचर डाइरेक्शन. पैरिस, फ्रांस, 17-18 मार्च 2005. 31 दिसम्बर 2006 को अभिगम.
- रेविस डी.आर. और सिगेल एम.बी. 2006. त्वचा, ग्राफ्ट्स. Emedicine.com. 31 दिसम्बर 2006 को अभिगम.
- स्टीलमैन आर.एम. 2006. घाव देखभाल. Emedicine.com. 31 दिसम्बर 2006 को अभिगम.
- विलहेल्मी बी.जे. 2006. घाव भरने, चौड़ी और हाइपरट्रॉफिक निशान. Emedicine.com. 31 दिसम्बर 2006 को अभिगम.
- जर्नल ऑफ़ बर्न्स एंड वुंड्स [3]
- फाइबरोजेनेसिस और ऊतकों की मरम्मत, क्रोनिक विंड हीलिंग और फाइबरोजेनेसिस के साथ एक ऑनलाइन ओपन एक्सेस जर्नल.
- अमेरिकी मेडिकल वीडियो जर्नल से घाव भरने वाले वीडियो के चरण
- ईडब्ल्यूएमए (EWMA) जर्नल, यूरोपीय वुंड मैनेजमेंट एसोसिएशन के जर्नल