"ताम्र": अवतरणों में अंतर
छो r2.7.1) (robot Adding: za:Doengz |
VibhijainBot (वार्ता | योगदान) छो →Products: Adding Template using AWB |
||
| पंक्ति 94: | पंक्ति 94: | ||
{{Link FA|es}} |
{{Link FA|es}} |
||
[[af:Koper]] |
[[af:Koper]] |
||
[[am:መዳብ]] |
[[am:መዳብ]] |
||
| पंक्ति 230: | पंक्ति 229: | ||
[[zh-yue:銅]] |
[[zh-yue:銅]] |
||
[[zu:Umthofu]] |
[[zu:Umthofu]] |
||
{{उत्तम लेख}} |
|||
11:59, 5 जून 2011 का अवतरण
ताम्र या तांबा या कॉपर एक भौतिक तत्त्व है। इसका संकेत Cu (अंग्रेज़ी - Copper, लैटिन - Cuprum) है । इसकी परमाणु संख्या 29 और परमाणु भार 63.5 है । यह एक तन्य धातु है जिसका प्रयोग विद्युत के चालक के रूप में प्रधानता से किया जाता है ।
मानव सभ्यता के इतिहास में तांबा का एक प्रमुख स्थान है क्योंकि प्राचीन काल में मानव द्वारा सबसे पहले प्रयुक्त धातुओं और मिश्रधातुओं में तांबा और कांसे (जोकि तांबा और टिन से मिलकर बनता है) का नाम आता है ।
समस्थानिक
कम क्षयशील समस्थानिक 63 तथा 65 के अलावा तांबे के कोई 2 दर्जन समस्थानिक हैं जो क्षयशील (रेडियोसमस्थानिक) हैं ।
गुण
ताम्र धातु विद्युत तथा उष्मी का सुचालक है । इस सुचालकता की श्रेणी में यह चांदी के बाद दूसरे क्रम पर आता है । इसमें एक लालिमा जैसी चमक होती है । यह सामान्यतया जल से अभिक्रिया नहीं करता है पर वायव्य ऑक्सीजन से धीरे धीरे संयोग कर ऑक्साईड बनाता है । लेकिन लोहे में जंग लगने से बिल्कुल अलग इसका ऑक्साईड धातु के ऊपर एक परत बनाता है जो इसके और ऑक्सीकरण को रोकता है । यह परत स्टैट्यू ऑफ़ लिबर्टी (न्यूयॉर्क) पर भी देखी जा सकती है ।
निष्कर्षण
तांबे के प्रमुख अयस्कों में कॉपर ग्लांस(Cu2S), कॉपर पाइराइट्स(CuFeS2), क्यूप्राइट (Cu2O) तथा मैकेलाईट (Cu(OH)2.CuCO3) के नाम आते हैं । पहले फेन प्लावन विधि से अयस्क का सांद्रण कर लिया जाता है । सांद्रित अयस्क को महीन चूर्ण करके ुसे एक परवर्तनी भट्ठी में वायु प्रवाह की उपस्थिति में भर्जित करते हैं । इस प्रक्रिया द्वारा क्यूप्रस सल्फाईड(Cu2S) और फेरस सल्फाईड (FeS) का मिश्रण प्राप्त होता है । अशुद्धियाँ आक्सीकृत होकर निल जाती हैं ।
इसके बाद इसे कोक के साथ वात्या भट्ठी में गर्म करते हैं जिससे फेरस सल्फाईड फेरस ऑक्साईड बनाता है तथा सिलिका के साथ अभिक्रिया करके धातुमल (फेरस सिलिकेट) बनाता हुआ निकल जाता है । इसके बाद इस को एक भट्ठी में गर्म करते हैं तो कॉपर के सल्फाईड पहले आक्साइड में बदल जाते हैं तथा फिर बचे हुए सल्फाइड से अभिक्रिया करके सल्फर डाई ऑक्साईड तथा कॉपर देते हैं ।
- 2Cu2S + 3 O2 → 2Cu2O + 2 SO2
- 2Cu2O + Cu2S → 6Cu + SO2
| ताम्र / Copper रासायनिक तत्व | |
 | |
| रासायनिक चिन्ह: | Cu |
| परमाणु संख्या: | 29 |
| रासायनिक शृंखला: | transition metals |
 आवर्त सारणी में स्थिति
| |
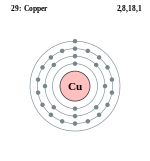 | |
| अन्य भाषाओं में नाम: | Copper (अंग्रेज़ी), Медь (रूसी), 銅 (जापानी) |
चित्र
-
Ankh, symbol for copper
-
alchemical symbol for copper
-
copper nugget
-
Prášková měď
-
Fosforečnan měďnatý - Cu3(PO4)2
-
Oxid měďnatý - CuO
-
Foods rich in copper
Flame test
-
Flame test on copper sulphate
-
Flame test on copper sulphate seen through cobalt glass
-
The flame test carried out on a copper halide.
Copper extraction
-
Crystals of native copper
-
Mineral copper
-
Native copper
-
Native copper etched to show crystals
-
Cuprite (copper ore)
-
Dissolved copper from deep underground cools to form the Primary orebody
-
Air or water oxidizes some of the orebody
-
Water enriches copper below the oxidized zone creating Secondary enrichment zone (violet)
-
The El Chino open-pit copper mine in New Mexico.
-
Coppermine Chuquicamata, Chile
Products
-
Copper ingot from Zakros, Crete
-
Repoussé from Tibet, 16th Century.
-
Treccia in rame.
-
Tubo in rame.
-
Tubo in rame.
-
Copper tube.
| समूह → | १ | २ | ३ | ४ | ५ | ६ | ७ | ८ | ९ | १० | ११ | १२ | १३ | १४ | १५ | १६ | १७ | १८ | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ आवर्त | |||||||||||||||||||||
| ० | ० / | ||||||||||||||||||||
| १ | १ H |
२ He | |||||||||||||||||||
| २ | ३ Li |
४ Be |
५ B |
६ C |
७ N |
८ O |
९ F |
१० Ne | |||||||||||||
| ३ | ११ Na |
१२ Mg |
१३ Al |
१४ Si |
१५ P |
१६ S |
१७ Cl |
१८ Ar | |||||||||||||
| ४ | १९ K |
२० Ca |
२१ Sc |
२२ Ti |
२३ V |
२४ Cr |
२५ Mn |
२६ Fe |
२७ Co |
२८ Ni |
२९ Cu |
३० Zn |
३१ Ga |
३२ Ge |
३३ As |
३४ Se |
३५ Br |
३६ Kr | |||
| ५ | ३७ Rb |
३८ Sr |
३९ Y |
४० Zr |
४१ Nb |
४२ Mo |
४३ Tc |
४४ Ru |
४५ Rh |
४६ Pd |
४७ Ag |
४८ Cd |
४९ In |
५० Sn |
५१ Sb |
५२ Te |
५३ I |
५४ Xe | |||
| ६ | ५५ Cs |
५६ Ba |
* |
७२ Hf |
७३ Ta |
७४ W |
७५ Re |
७६ Os |
७७ Ir |
७८ Pt |
७९ Au |
८० Hg |
८१ Tl |
८२ Pb |
८३ Bi |
८४ Po |
८५ At |
८६ Rn | |||
| ७ | ८७ Fr |
८८ Ra |
** |
१०४ Rf |
१०५ Db |
१०६ Sg |
१०७ Bh |
१०८ Hs |
१०९ Mt |
११० Ds |
१११ Rg |
११२ Cn |
११३ Nh |
११४ Fl |
११५ Mc |
११६ Lv |
११७ Ts |
११८ Og | |||
| ८ | ११९ Uue |
१२० Ubn |
*** | ||||||||||||||||||
| * लैन्थनाइड | ५७ La |
५८ Ce |
५९ Pr |
६० Nd |
६१ Pm |
६२ Sm |
६३ Eu |
६४ Gd |
६५ Tb |
६६ Dy |
६७ Ho |
६८ Er |
६९ Tm |
७० Yb |
७१ Lu | ||||||
| ** ऐक्टिनाइड | ८९ Ac |
९० Th |
९१ Pa |
९२ U |
९३ Np |
९४ Pu |
९५ Am |
९६ Cm |
९७ Bk |
९८ Cf |
९९ Es |
१०० Fm |
१०१ Md |
१०२ No |
१०३ Lr | ||||||
| *** महालैन्थनाइड | १२१ Ubu |
१२२ Ubb |
१२३ Ubt |
१२४ Ubq |
१२५ Ubp |
१२६ Ubh |
१२७ Ubs |
१२८ Ubo |
१२९ Ube |
१३० Utn |
१३१ Utu |
१३२ Utb |
१३३ Utt |
१३४ Utq |
१३५ Utp |
१३६ Uth |
१३७ Uts |
१३८ Uto | |||
आवर्त सारणी के इस प्रचलित प्रबन्ध में लैन्थनाइड और ऐक्टिनाइड को अन्य धातुओं से अलग रखा गया है। विस्तृत और अति-विस्तृत आवर्त सारणीओं में एफ़-खण्ड और जी-खण्ड धातुओं को भी एक साथ प्रबन्धित किया जाता है।
|
आवर्त सारणी में तत्त्वों की श्रेणियाँ
| ||||||||||||||||||||||
|
| |||||||||||||||||||||

































