"कार्बन": अवतरणों में अंतर
अनुनाद सिंह (वार्ता | योगदान) No edit summary |
No edit summary |
||
| पंक्ति 1: | पंक्ति 1: | ||
{{आज का आलेख}} |
{{वार्ता शीर्षक}}{{आज का आलेख}} |
||
[[चित्र:Koh-i-Noor new version copy.jpg|thumb|right|250px|कार्बन का एक बहुरूप हीरा।]] |
[[चित्र:Koh-i-Noor new version copy.jpg|thumb|right|250px|कार्बन का एक बहुरूप हीरा।]] |
||
[[चित्र:GraphiteUSGOV.jpg|thumb|250px|right|कार्बन का एक अन्य बहुरूप ग्रेफाइट।]] |
[[चित्र:GraphiteUSGOV.jpg|thumb|250px|right|कार्बन का एक अन्य बहुरूप ग्रेफाइट।]] |
||
| पंक्ति 16: | पंक्ति 16: | ||
'''कार्बन के आक्साइड'''- कार्बन के तीन आक्साइड ज्ञात हैं - |
'''कार्बन के आक्साइड'''- कार्बन के तीन आक्साइड ज्ञात हैं - |
||
*(1) कार्बन मोनोक्साइड CO तथा |
*(1) कार्बन मोनोक्साइड CO तथा |
||
*(2) कार्बन डाइआक्साइड CO2 |
*(2) कार्बन डाइआक्साइड CO2 |
||
ये दोनों गैसें हैं और अत्यन्त महत्त्वपूर्ण हैं. |
ये दोनों गैसें हैं और अत्यन्त महत्त्वपूर्ण हैं. |
||
| पंक्ति 31: | पंक्ति 31: | ||
O =C =O है. यह दहन में सहायक नहीं है. यल में विलयित होकर कार्वोनिक अम्ल |
O =C =O है. यह दहन में सहायक नहीं है. यल में विलयित होकर कार्वोनिक अम्ल |
||
H2CO3 बनाती है. |
H2CO3 बनाती है. |
||
[[चित्र:आवर्त सारणी.jpg|700px]] |
[[चित्र:आवर्त सारणी.jpg|700px]] |
||
| पंक्ति 58: | पंक्ति 57: | ||
{{Link FA|pt}} |
{{Link FA|pt}} |
||
{{Link FA|sk}} |
{{Link FA|sk}} |
||
[[af:Koolstof]] |
[[af:Koolstof]] |
||
[[als:Kohlenstoff]] |
[[als:Kohlenstoff]] |
||
12:51, 24 अप्रैल 2011 का अवतरण


पृथ्वी पर पाए जाने वाले तत्वों में कार्बन एक प्रमुख एवं महत्त्वपूर्ण तत्त्व है। इस रासायनिक तत्त्व का संकेत C तथा परमाणु संख्या ६, मात्रा संख्या १२ एवं परमाणु भार १२.००० है। कार्बन के तीन प्राकृतिक समस्थानिक 6C12, 6C13 एवं 6C14 होते हैं। कार्बन के समस्थानिकों के अनुपात को मापकर प्राचीन तथा पुरातात्विक अवशेषों की आयु मापी जाती है।[1] कार्बन के परमाणुओं में कैटिनेशन नामक एक विशेष गुण पाया जाता है जिसके कारण कार्बन के बहुत से परमाणु आपस में संयोग करके एक लम्बी शृंखला का निर्माण कर लेते हैं। इसके इस गुण के कारण पृथ्वी पर कार्बनिक पदार्थों की संख्या सबसे अधिक है। यह मुक्त एवं संयुक्त दोनों ही अवस्थाओं में पाया जाता है।[2]
इसके विविध गुणों वाले कई बहुरूप हैं जिनमें हीरा, ग्रेफाइट काजल, कोयला प्रमुख हैं। इसका एक अपरूप हीरा जहाँ अत्यन्त कठोर होता है वहीं दूसरा अपरूप ग्रेफाइट इतना मुलायम होता है कि इससे कागज पर निशान तक बना सकते हैं। हीरा विद्युत का कुचालक होता है एवं ग्रेफाइट सुचालक होता है। इसके सभी अपरूप सामान्य तापमान पर ठोस होते हैं एवं वायु में जलकर कार्बन डाइ-आक्साइड गैस बनाते हैं। हाइड्रोजन, हीलियम एवं आक्सीजन के बाद विश्व में सबसे अधिक पाया जाने वाला यह तत्व विभिन्न रूपों में संसार के समस्त प्राणियों एवं पेड़-पौधों में उपस्थित है। यह सभी सजीवों का एक महत्त्वपूर्ण अवयव होता है, मनुष्य के शरीर में इसकी मात्रा १८.५ प्रतिशत होती है और इसको जीवन का रासायनिक आधार कहते हैं।
कार्बन शब्द लैटिन भाषा के कार्बो शब्द से आया है जिसका अर्थ कोयला या चारकोल होता है। कार्बन की खोज प्रागैतिहासिक युग में हुई थी। कार्बन तत्व का ज्ञान विश्व की प्राचीनतम सभ्यताओं को भी था। चीन के लोग ५००० वर्षों पहले हीरे के बारे में जानते थे और रोम के लोग लकड़ी को मिट्टी के पिरामिड से ढककर चारकोल बनाते थे। लेवोजियर ने १७७२ में अपने प्रयोगो द्वारा यह प्रमाणित किया कि हीरा कार्बन का ही एक अपरूप है एवं कोयले की ही तरह यह जलकर कार्बन डाइ-आक्साइड गैस उत्पन्न करता है। कार्बन का बहुत ही उपयोगी बहुरूप फुलेरेन की खोज १९९५ ई. में राइस विश्वविद्यालय के प्रोफेसर आर इ स्मैली तथा उनके सहकर्मियों ने की। इस खोज के लिए उन्हें वर्ष १९९६ ई. का नोबेल पुरस्कार प्राप्त हुआ।
कार्बन के यौगिक
कार्बन के असंख्य यौगिक हैं जिन्हें कार्बनिक रसायन के अन्तर्गत अध्ययन करते हैं।
कार्बन के अकार्बनिक यौगिक
यद्यपि कार्बन के यौगिकों का वर्णन कार्बीनिक रसायन का मुख्य विषय है किन्तु अकार्बीनिक रसायन में कार्बन के आक्साइडों तथा कार्बन डाइसल्फाइड का वर्णन किया जाता है.
कार्बन के आक्साइड- कार्बन के तीन आक्साइड ज्ञात हैं -
- (1) कार्बन मोनोक्साइड CO तथा
- (2) कार्बन डाइआक्साइड CO2
ये दोनों गैसें हैं और अत्यन्त महत्त्वपूर्ण हैं.
- (3) कार्बन आक्साइड C3O3 या ट्राइकार्बन आक्साइड अरुचिकर गैस है.
कार्बन डाइआक्साइड CO2- रंगहीन गंधहीन गैस जो जल के अतिरिक्त ऐसीटोन तथा एथेनाल में भी विलेय है. यह वायुमण्डल में 03% तक (आयतन के अनुसार) पाई जाती है और पौधों द्वारा प्रकाशसंश्लेषण के समय आत्मसात कर ली जाती है. इसे धातु
कार्बोनेटों पर अम्ल की क्रिया द्वारा या भारी धातु कार्बोनेटों को गर्म करके प्राप्त किया जाता है. उच्च ताप पर द्रवीभूत होती है. प्रयोगशाला में संगमरमर पर HHCl की क्रिया द्वारा निर्मित CCO3 + 2HHCl - CHCl2 +H2O +CO2 इसका अणु रैखिक है अत: इसकी संरचना O =C =O है. यह दहन में सहायक नहीं है. यल में विलयित होकर कार्वोनिक अम्ल H2CO3 बनाती है.
| कार्बन / Carbon रासायनिक तत्व | |
 | |
| रासायनिक चिन्ह: | C |
| परमाणु संख्या: | 6 |
| रासायनिक शृंखला: | nonmetals |
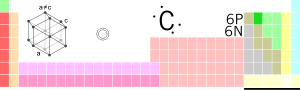 आवर्त सारणी में स्थिति
| |
 | |
| अन्य भाषाओं में नाम: | Carbon (अंग्रेज़ी), Углерод (रूसी), 炭素 (जापानी) |
संदर्भ
- ↑ "कार्बन के समस्थानिकों में जलवायु और सभ्यता के हस्ताक्षर". होमी भाभा विज्ञान शिक्षा केन्द्र. नामालूम प्राचल
|accessyear=की उपेक्षा की गयी (|access-date=सुझावित है) (मदद); नामालूम प्राचल|accessmonthday=की उपेक्षा की गयी (मदद) - ↑ प्रसाद, चन्द्र मोहन (जुलाई 2004). भौतिक एवं रसायन विज्ञान. कोलकाता: भारती सदन. पृ॰ 232. नामालूम प्राचल
|accessday=की उपेक्षा की गयी (मदद); नामालूम प्राचल|accessyear=की उपेक्षा की गयी (|access-date=सुझावित है) (मदद); नामालूम प्राचल|accessmonth=की उपेक्षा की गयी (|access-date=सुझावित है) (मदद)


