तानिकाशोथ
| यह लेख एक आधार है। जानकारी जोड़कर इसे बढ़ाने में विकिपीडिया की मदद करें। |
| Meningitis वर्गीकरण एवं बाह्य साधन | |
 | |
|---|---|
| Meninges of the central nervous system: dura mater, arachnoid, and pia mater. | |
| आईसीडी-१० | G00.–G03. |
| आईसीडी-९ | 320–322 |
| डिज़ीज़-डीबी | 22543 |
| मेडलाइन प्लस | 000680 |
| ईमेडिसिन | med/2613 emerg/309 emerg/390 |
| एम.ईएसएच | D008581 |
तानिकाशोथ या मस्तिष्कावरणशोथ या मेनिन्जाइटिस (Meningitis) मस्तिष्क तथा मेरुरज्जु को ढंकने वाली सुरक्षात्मक झिल्लियों the 20th (मस्तिष्कावरण) में होने वाली सूजन होती है।[1] यह सूजन वायरस, बैक्टीरिया तथा अन्य सूक्ष्मजीवों से संक्रमण के कारण हो सकती है साथ ही कम सामान्य मामलों में कुछ दवाइयों के द्वारा भी हो सकती है।[2] इस सूजन के मस्तिष्क तथा मेरुरज्जु के समीप होने के कारण मेनिन्जाइटिस जानलेवा हो सकती है; तथा इसीलिये इस स्थिति को चिकित्सकीय आपात-स्थिति के रूप में वर्गीकृत किया गया है।[1][3]
मेनिन्जाइटिस के सबसे आम लक्षण सर दर्द तथा गर्दन की जकड़न के साथ-साथ बुखार, भ्रम अथवा परिवर्तित चेतना, उल्टी, प्रकाश को सहन करने में असमर्थता (फ़ोटोफोबिया) अथवा ऊंची ध्वनि को सहन करने में असमर्थता (फ़ोनोफोबिया) हैं। बच्चे अक्सर सिर्फ गैर विशिष्ट लक्षण जैसे, चिड़चिड़ापन और उनींदापन प्रदर्शित करते हैं। यदि कोई ददोरा भी दिख रहा है, तो यह मेनिन्जाइटिस के विशेष कारण की ओर संकेत हो सकता है; उदाहरण के लिये, मेनिन्गोकॉकल बैक्टीरिया के कारण होने वाले मेनिन्जाइटिस में विशिष्ट ददोरे हो सकते हैं।[1][4]
मेनिन्जाइटिस के निदान अथवा पहचान के लिये लंबर पंक्चर की आवश्यकता हो सकती है। स्पाइनल कैनाल में सुई डाल कर सेरिब्रोस्पाइनल द्रव (CSF) का एक नमूना निकाला जाता है जो मस्तिष्क तथा मेरुरज्जु को आवरण किये रहता है। सीएसएफ़ का परीक्षण एक चिकित्सा प्रयोगशाला में किया जाता है।[3] तीव्र मैनिन्जाइटिस के प्रथम उपचार में तत्परता के साथ दी गयी एंटीबायोटिक तथा कुछ मामलों में एंटीवायरल दवा शामिल होती हैं। अत्यधिक सूजन से होने वाली जटिलताओं से बचने के लिये कॉर्टिकोस्टेरॉयड का प्रयोग भी किया जा सकता है।[3][4] मेनिन्जाइटिस के गंभीर दीर्घकालिक परिणाम हो सकते हैं जैसे बहरापन, मिर्गी, हाइड्रोसेफॉलस तथा संज्ञानात्मक हानि, विशेष रूप से तब यदि इसका त्वरित उपचार न किया जाये।[1][4] मेनिन्जाइटिस के कुछ रूपों से (जैसे कि मेनिन्जोकॉकी, हिमोफिलस इन्फ्लुएंजा टाइप बी, न्यूमोकोकी अथवा मम्स वायरस संक्रमणों से संबंधित) प्रतिरक्षण के द्वारा बचाव किया जा सकता है।[1]
संकेत और लक्षण
नैदानिक लक्षण

वयस्कों में, मेनिन्जाइटिस का सबसे सामान्य लक्षण तीव्र सर दर्द है, जो बैक्टेरियल मेनिन्जाइटिस के लगभग 90% मामलों में प्रदर्शित होता है, जिसके पश्चात गर्दन के पिछले भाग में जकड़न (गर्दन को आगे झुकाने में होने वाली कठिनाई जो कि गर्दन की मांसपेशियों में तनाव के बढ़ने के कारण तथा उनमें होने वाली अकड़न के कारण होती है)।[5] निदान के तीन परंपरागत लक्षणों में गर्दन के पिछले भाग में जकड़न, अचानक उच्च बुखार, तथा मानसिक स्थिति में बदलाव शामिल हैं; हालाँकि, ये तीनों लक्षण बैक्टीरिया जनित मेनिन्जाइटिस के 44–46% मामलों में ही प्रदर्शित होते हैं।[5][6] अगर इन तीनों में से कोई भी संकेत मौजूद नहीं है, तो मेनिन्जाइटिस की संभावना बहुत कम होती है।[6] सामान्यतः मेनिन्जाइटिस के साथ जुड़े अन्य संकेतों में फोटोफ़ोबिया (तीव्र प्रकाश को सहन करने में असमर्थता) तथा फोनोफ़ोबिया(तीव्र ध्वनियों को सहन करने में असमर्थता) शामिल हैं। छोटे बच्चे अक्सर उपर्युक्त लक्षण नहीं प्रदर्शित करते हैं, वे सिर्फ चिड़चिड़े हो जाते हैं तथा अस्वस्थ दीखते हैं।[1] 6 माह तक के नवजात शिशुओं में फॉन्टानेल (बच्चे के सिर के शीर्ष पर नरम स्थान) में उभार आ सकता है। अन्य लक्षण जो मेनिन्जाइटिस को अन्य कम गंभीर बीमारियों से अलग करते हैं वे हैं पैरों में दर्द, अत्यधिक जुकाम तथा असामान्य त्वचा का रंग।[7][8]
वयस्कों में बैक्टीरिया जनित मेनिन्जाइटिस के 70% मामलों में गर्दन के पिछले भाग में जकड़न प्रदर्शित होती है।[6] मेनिन्जिज़्म के अन्य लक्षणों में सकारात्मक कर्निग लक्षण अथवा ब्रुज़िन्स्की लक्षण शामिल हैं। कर्निग लक्षण का पता लगाने के लिये व्यक्ति को सुपाइन (चेहरा ऊपर करके लेटना) में लिटाकर उसके कूल्हों तथा घुटनों को 90 डिग्री के कोण पर लाया जाता है। कोई व्यक्ति जिसमें कर्निग लक्षण पॉजिटिव होते हैं, घुटने का दर्द घुटने के निष्क्रिय विस्तार को रोक देता है। ब्रुज़िन्स्की लक्षण को सकारात्मक पाया जाता है जबकि व्यक्ति की गर्दन को घुमाने से उसके उसके घुटने तथा कूल्हे अनैच्छिक रूप से घूमते हैं। हालाँकि कर्निग लक्षण व ब्रुज़िन्सकी लक्षण मेनिन्जाइटिस को पहचानने के लिये किये जाने वाले सामान्य परीक्षण हैं, इन परीक्षणों की संवेदनशीलता सीमित है।[6][9] हालाँकि मेनिन्जाइटिस के लिये इनकी संवेदनशीलता बहुत अच्छी हैं: किसी अन्य बीमारी में ये लक्षण अन्य रोगों में बहुत कम होते हैं।[6] एक अन्य परीक्षण, जिसे “आघात स्वरोच्चारण युक्ति” (ज़ोल्ट एक्सेन्चुएशन मेनूवर) कहते हैं, से यह पता चलता है जो लोग बुखार व सिरदर्द की शिकायत कर रहे हैं, उनमें मेनिन्जाइटिस विद्यमान है या नहीं। व्यक्ति को तेजी से सिर को क्षैतिज रूप से घुमाने के लिये कहा जाता है; यदि इसके कारण उसका सिरदर्द बढ़ता नहीं है, तो मेनिन्जाइटिस होने की सम्भावना नहीं होती है।[6]
नेइसेरिया मेनिन्जाइटाईडिस नामक जीवाणु से होने वाले मेनिन्जाइटिस (जिसे मेनिन्गोकॉकल मेनिन्जाइटिस भी कहते हैं) को अन्य कारणों से होने वाले मेनिन्जाइटिस से अलग पेटीकियल ददोरों के द्वारा पहचाना जा सकता है, जो अन्य लक्षणों से पहले प्रकट होता है।[7]इन ददोरों में धड़ पर, निचला सिरा, श्लेष्म झिल्ली, कन्जक्टिवा, तथा (कभी-कभार) हथेलियों तथा पैरों के तलवों पर कई छोटे-छोटे अनियमित बैंगनी या लाल धब्बे होते हैं ("पेटीकियाई")। दाने आमतौर पर गैर-विरंजित होते हैं; जब उंगली या कांच के गिलास के साथ दबाया जाता है तो लाली गायब नहीं होती है। हालाँकि मेनिंगोकॉकल मेनिन्जाइटिस में इन दानों का होना आवश्यक नहीं है, फिर भी यह अपेक्षाकृत रूप से रोग के लिए विशिष्ट है; हालाँकि ये अन्य जीवाणुओं की वजह से होने वाले होते मेनिन्जाइटिस में भी हो सकते हैं।[1] मेनिन्जाइटिस के होने के अन्य कारणों का पता त्वचा के निशानों हाथ, पैर तथा मुंह की बीमारियाँ तथा जननांगों का हर्पीज़ से लगाया जा सकता है, जिनमें से दोनों वायरल मेनिन्जाइटिस के विभिन्न रूपों के साथ जुड़े हैं।[10]
प्रारंभिक जटिलतायें

बीमारी के प्रारंभिक चरण में अतिरिक्त समस्यायें हो सकती हैं। इनके लिये विशेष उपचार की आवश्यकता हो सकती है, तथा कभी-कभी ये गंभीर बीमारी का संकेत अथवा बदतर रोगों का पूर्वानुमान हो सकती हैं। यह संक्रमण सेप्सिस को शुरु कर सकता है, जो कि घटते हुए रक्तचाप का एक सिस्टमिक इन्फ्लैमैटरी रेस्पोंस सिंड्रोम है, तीव्र ह्रदय गति, उच्च या असामान्य रूप से कम तापमान, तथा उच्च श्वसनदर। विशिष्टतः परन्तु मेनिन्गोकॉकल मेनिन्जाइटिस में अनिवार्यतः नहीं, रक्तचाप अति निम्न हो सकता है; इसके कारण अन्य अंगों को रक्त की आपूर्ति अपर्याप्त रूप से हो सकती है।[1] डेसिमिनेटेड इंट्रावैस्कुलर कॉग्युलेशन, जो कि रक्त के थक्के बनने का अत्यधिक सक्रियण हैं, अंगों के लिए रक्त के बहाव में बाधा डाल कर विरोधाभासी रूप से रक्तस्राव के खतरे को बढ़ा देता है। मेनिन्गोकोकल व्याधि में हाथ-पैरों का गैंगरीन हो सकता है।[1] गंभीर मेनिन्गोकॉकल तथा न्यूमोकोकल संक्रमण के परिणामस्वरूप एड्रीनल ग्रंथियों में हैमरेज (रक्तस्राव) हो सकता है, जिसके कारण वाटरहाउस-फ्रेडरिक्सन सिंड्रोम हो सकता है जो कि अधिकांशतः घातक होता है।[11]
मस्तिष्क के ऊतकों में सूजन, खोपड़ी के अंदर का दबाव बढ़ सकता है, तथा सूजा हुआ मस्तिष्क खोपड़ी के आधार से हर्नियेट कर सकता है। इसको कम होती हुई चेतना के स्तर, प्यूपिलरी प्रकाश प्रतिवर्त में कमी, तथा असामान्य मुद्रा के द्वारा पहचाना जा सकता है।[4] मस्तिष्क के ऊतकों की सूजन के कारण मस्तिष्क के इर्द-गिर्द सीएसएफ़ (CSF) के सामान्य प्रवाह में कमी आ सकती है (हाइड्रोसेफ्लस)।[4] दौरे कई कारणों से पड़ सकते हैं; बच्चों में, मेनिन्जाइटिस के प्रारंभिक चरण में दौरे सामान्य हैं (लगभग 30% मामलों में) तथा किसी अंतर्निहित कारण का आवश्यक रूप से संकेत नहीं हैं।[3] दौरे मस्तिष्क के ऊतकों में सूजन तथा मस्तिष्क के दबाव के कारण पड़ते हैं।[4] फोकल दौरे (वे दौरे जिनमें एक हाथ या पैर अथवा शरीर का कोई एक भाग शामिल होता है), निरंतर दौरे, देर से शुरू होने वाले दौरे तथा वे जिन्हें दवाओं से नियंत्रित नहीं किया जा सकता, दीर्घकालिक परिणाम के अच्छे नहीं होने संकेत देते हैं।[1]
मेनिन्जाइटिस की सूजन कपाल की नसों में असामान्यता का कारण बन सकते हैं, ये नसों का वह समूह हैं जो मस्तिष्क स्टेम से निकलती हैं, सिर तथा ग्रीवा भागों को आपूर्ति करती हैं तथा जो अन्य कार्यों के साथ ही आँखों की गतिविधि, चेहरे की मांसपेशियों तथा श्रवण को नियंत्रित करती हैं।[1][6] दृश्य लक्षण तथा श्रवण हानि मेनिन्जाइटिस के प्रकरण के बाद भी बने रह सकते हैं।[1] दिमाग की सूजन (मस्तिष्क की सूजन) अथवा इसकी रक्त धमनियों की सूजन (सेरिब्रल वैस्कुलाइटिस), के साथ ही धमनियों में रक्त के थक्के का बनना (सेरिब्रल वेनस थ्राम्बोसिस), में से सभी के कारण कमजोरी, संवेदना में कमी, अथवा मस्तिष्क के प्रभावित क्षेत्र के द्वारा आपूर्ति किये जाने वाले शरीर के भागों में असामान्य गतिविधियाँ हो सकती हैं।[1][4]
कारण
मस्तिष्क ज्वर आम तौर पर सूक्ष्मजीवों द्वारा होने वाला एक संक्रमण है। अधिकतर संक्रमण वायरस के कारण होते हैं तथा[6] बैक्टीरिया, फंगी और प्रोटोज़ोआ अन्य सबसे आम कारण हैं।[2] यह कई गैर-संक्रमण कारणों से भी हो सकता है।[2] शब्द असेप्टिक मेनिन्जाइटिस उन मामलों को बताता है जिनमें कोई बैक्टीरिया जनित संक्रमण प्रदर्शित नहीं होते हैं। इस प्रकार का मस्तिष्क ज्वर आम तौर पर वायरस के कारण होता है, लेकिन यह ऐसे बैक्टीरिया जनित संक्रमणों के कारण भी हो सकता है जिनका पहले आंशिक उपचार हो चुका हो, जब मस्तिष्क ज्वर से बैक्टीरिया समाप्त हो जाते हैं या पैथोजन मस्तिष्क ज्वर से सटे स्थान को संक्रमित करते हैं (उदाहरण के लिये साइनोसाइटिस)। एंडोकार्डाइटिस (दिल के वॉल्व का एक संक्रमण जो रक्त प्रवाह के माध्यम से बैक्टीरिया के छोटे गुच्छों को फैलाता है) से भी असेप्टिक मस्तिष्क ज्वर हो सकता है। असेप्टिक मस्तिष्क ज्वर, स्पाएरोशेट (सर्पकीट) से संक्रमण के कारण भी हो सकता है, यह एक प्रकार का कीट है जिसमें ट्रेपोनेमा पैलिडम (सिफलिस का कारक) और बोरेलिया बर्गडॉरफेरि (लाइम रोग पैदा करने के लिये जाना जाने वाला) शामिल है। मस्तिष्क ज्वर में सेरेब्रल मलेरिया (मस्तिष्क को प्रभावित करने वाला मलेरिया) या अमीओबिक मेनिन्जाइटिस, अमीबा जैसे नाइग्लेरिया फाउलेरी से संक्रमण के कारण होने वाले मस्तिष्क ज्वर से हो सकता है जो स्वच्छ हवा स्रोतों के संपर्क से फैलते हैं।[2]
बैक्टीरिया जनित
बैक्टीरिया जनित मस्तिष्क ज्वर फैलाने वाले बैक्टीरिया व्यक्ति के उम्र समूह के अनुसार भिन्न-भिन्न होते है। * समय पूर्व जन्मे और तीन माह तक के नवजात शिशुओं में आम कारण ग्रुप बी स्ट्रेप्टोकॉकि (उपप्रकार III जो आमतौर पर योनि मे होता है, वह मुख्य कारण हैं जो पहले सप्ताह के जीवन में रोग होने का कारण है) और पाचन तंत्र में आमतौर पर रहने वाले बैक्टीरिया जैसे एस्क्रीचिया कोली (जो K1 एंटीजन रखता है) होते हैं। लिस्टीरिया मोनोसाइटोजिनिस (सेरोटाइप IV बी) नवजात को प्रभावित कर सकता है और महामारी के दौरान होता है।
- अधिक उम्र वाले बच्चे आमतौर पर निएसेरिया मेनिन्जाइटिडिस (मेनिन्जोकॉकस) और स्ट्रेप्टोकॉकस निमोनिया (सेरोटाइप 6, 9, 14, 18 और 23) से और पांच से कम उम्र वाले बच्चे हीमोफिलस इन्फ्लुएन्ज़ा टाइप बी (उन देशों में जो टीकाकरण नहीं उपलब्ध कराते) द्वारा प्रभावित होते हैं।[1][3]
- वयस्कों में, निएसेरिया मेनिन्जाटिडिस और स्ट्रेप्टोकॉकस निमोनिया मिलकर बैक्टीरिया जनित मस्तिष्क ज्वर के 80% मामलों के लिये जिम्मेदार होते हैं। लिस्टीरिया मोनोसाइटोजिनिस के साथ संक्रमण का जोखिम 50 वर्ष से अधिक की उम्र वालों में बढ़ जाता है।[3][4] न्यूमोकॉकल वैक्सीन ने बच्चों और वयस्कों में न्यूमोकॉकल मस्तिष्क ज्वर की दर को कम कर दिया है।[12]
हाल के, खोपड़ी से जुड़ा आघात (ट्रॉमा) संभावित रूप से नसिका गुहा (नेसल कैविटी) बैक्टीरिया को मस्तिष्क आवरण स्थान में दाखिल होने देता है। इसी प्रकार से, मस्तिष्क और मस्तिष्क आवरण की युक्तियों जैसे मस्तिष्क पार्श्वपथ (सेरेब्रल शंट), एक्स्ट्रावेंट्रिक्युलर ड्रेन या ओमाया रिसर्वायर, में मस्तिष्क ज्वर का बढ़ा हुआ जोखिम होता है। इन मामलों में, लोगों को स्टैफिलोकॉकी, स्यूडोमोनॉस और दूसरे ग्राम-निगेटिव बैक्टीरिया से संक्रमित होने की संभावना होती है।[3] ये पैथोजन दुर्बल प्रतिरोधी प्रणाली वाले मस्तिष्क ज्वर से पीड़ित लोगों से संबंधित है।[1] सर व गर्दन के क्षेत्र के संक्रमण जैसे ओटिटिस मीडिया या मास्टोइडिटिस, थोड़े लोगों में ही मस्तिष्क ज्वर पैदा कर सकते है।[3] सुनने की समस्या के कारण कर्णावर्त प्रत्यारोपण करवाने वाले लोगों में न्यूमोकॉकल मस्तिष्क ज्वर होने का जोखिम अधिक होता है।[13]
तपेदिक मस्तिष्क ज्वर, माइक्रोबैक्टीरियम ट्यूबरक्युलोसिस द्वारा होता है, उन देशों पर अधिक आम होता है जहां पर तपेदिक एक महामारी है, लेकिन इससे उन लोगों का सामना भी होता है जिनको प्रतिरक्षा तंत्र संबंधी समस्या जैसे एड्स होती है।[14]
बार-बार होने वाला बैक्टीरिया जनित मस्तिष्क ज्वर संरचनात्मक दोषों के बने रहने से होता है जो कि या तो जन्मजात या अर्जित या प्रतिरक्षा तंत्र के विकारों के कारण होते हैं।[15]शारीरिक दोष बाहरी वातावरण और स्नायु तंत्र के बीच निरंतरता को बनाते हैं। बार-बार होने वाले मस्तिष्क ज्वर का सबसे आम कारण खोपड़ी का फ्रैक्चर[15] है, विशेष रूप से वे फ्रैक्चर जो खोपड़ी के आधार को प्रभावित करते हैं या उनका विस्तार साइनस और पेट्रस पिरामिडकी ओर होता है।[15] बार-बार होने वाले मस्तिष्क ज्वर का लगभग 59% ऐसी शारीरिक असमान्यताओं के कारण, 36% प्रतिरक्षण कमजोरियों (जैसे पूरक कमियां, जो बार-बार होने वाले मैनिंगोकॉकल मस्तिष्क ज्वर की प्रवृत्ति रखती हैं) के कारण और 5%, मस्तिष्क आवरण से जुड़े क्षेत्रों में होने वाले संक्रमणों को कारण होता है।[15]
वायरस जनित
वे वायरस जो मस्तिष्क ज्वर पैदा कर सकते हैं उनमें एंट्रोवायरस, हरपीस सिम्पलेक्स वायरस टाइप 2 (और कम आम टाइप 1), वैरिसेला ज़ोस्टर वायरस (छोटी चेचक और दाद के जनक के रूप में विख्यात), कण्ठमाला रोग वायरस, HIV और LCMVशामिल हैं।[10]
फफूंद जनित
फफूंद जनित मस्तिष्क ज्वर के लिये बहुत सारे जोखिम कारक हैं जिनमें इम्युनोसप्रेसेन्ट (जैसे अंग प्रत्यारोपण के बाद) का उपयोग, HIV/AIDS[16] और उम्र बढ़ने के साथ प्रतिरक्षा की हानि शामिल है।[17] यह सामान्य प्रतिरक्षा तंत्र वाले लोगों में असमान्य है[18] लेकिन यह दवा संदूषण के कारण होता है।[19]लक्षण आम तौर पर धीरे-धीरे उभरते हैं, जिसमें निदान के पहले सरदर्द और बुखार कम से कम कुछ सप्ताह तक बना रहता है।[17] सबसे आम फफूंद जनित मस्तिष्क ज्वर क्रिप्टोकॉकल मस्तिष्क ज्वर है जो क्रिप्टोकॉकस नियोफॉर्मान्स के कारण होता है।[20] अफ्रीका में क्रिप्टोकॉकल मस्तिष्क ज्वर सबसे आम मस्तिष्क ज्वर कारक है[21] और यह अफ्रीका में एड्स संबंधी मौतों का 20–25% तक कारण होता है।[22] दूसरे आम फफूंद कारक एजेंटों में हिस्टोप्लास्मा कैप्स्यूलेटम, कॉक्सिडिओआइड इमिटस, ब्लास्टोमाइसेस डरमेटिटिडिस और कैन्डिडा जातियां शामिल है।[17]
परजीवी जनित
परजीवी जनित कारक अक्सर उनको माना जाता है जहां पर सीएसएफ में स्नोफिल्स (एक प्रकार की श्वेत रक्त कणिकाएं) की बहुतायत होती है। सबसे आम आरोपी परजीवी एंजियोस्ट्रॉन्गाएलस कैन्टूनेन्सस, ग्नेथॉस्तमाह स्पाइनिजिरम, शिस्टोस्टोमा तथा साथ ही स्थितियां सिस्टोरकोसिस, टॉक्सोकारियासिस, वेलिसएस्कॉरिसस, पैरागोनिमियासिस हैं और कई सारे दुर्लभ संक्रमण और गैरसंक्रामक परिस्थितियां भी इसमें शामिल हैं।[23]
गैर-संक्रामक
मस्तिष्क ज्वर गैर-संक्रामक कारकों के परिणामस्वरूप भी हो सकता है: मस्तिष्क आवरण में कैंसर (घातक या नियोप्लास्टिक मस्तिष्क ज्वर) का होना[24] और कुछ दवाएं (मुख्य रूप से गैर-स्टीरॉएड एंटी-इन्फ्लेमेटरी दवाएं, एंटीबायोटिक और इन्ट्रावेनस इम्युनोग्लोब्यूलिन)।[25] यह कई भड़काऊ परिस्थितियों के कारण भी होता है, जैसे कि सरकॉएडोसिस(जिसे इस स्थिति में न्यूरोसरकॉएडोसिस कहा जाता है) संयोजी ऊतक विकार जैसे सिस्टोमिक लंप्स एराइथेमेटोसस और कुछ प्रकार के वैस्क्युलाइटिस (रक्त वाहिका दीवार की भड़काऊ स्थितियां) जैसे बेहेस्टस रोग।[2]इपिडरमॉएड सिस्ट और डरमॉएड सिस्ट, सबअर्कनॉएड क्षेत्र में उत्तेजक पदार्थ जाने से मस्तिष्क ज्वर पैदा कर सकता है।[2][15] मोलारेट्स मेनिन्जाइटिस एक ऐसा सिन्ड्रोम है जो एसेप्टिक मस्तिष्क ज्वर के बार-बार होने वाला एपीसोड है; यह हरपीस सिम्पलेक्स वायरस टाइप 2के कारण होने वाला माना जाता है। कभी कभार, माइग्रेन मस्तिष्क ज्वर पैदा कर सकता है, लेकिन यह निदान आमतौर पर तब किया जाता है जब अन्य कारक समाप्त हो जाते हैं।[2]
क्रियातंत्र
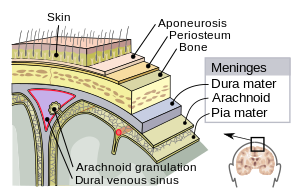
मस्तिष्क आवरण में तीन झिल्लियां शामिल होती हैं जो मस्तिष्क मेरु-द्रव्य के साथ मिल कर मस्तिष्क और रीढ़ की हड्डी (केन्द्रीय तंत्रिका तंत्र) को घेरता व सुरक्षित करता है। मृदु तानिका (पाया मेटर) एक बहुत नाजुक अभेद्य झिल्ली होती है जो सभी छोटे कॉन्ट्यूर्स के साथ मस्तिष्क की सतह पर दृढ़ता के साथ लगी होती है। अर्कनॉएड मेटर (अपने जाल जैसे दिखने के कारण इस नाम से पुकारा जाता है) एक ढ़ीली-ढ़ाली फिटिंग सैक होती है तो मृदु तानिका के ऊपर होती है। सबअर्कनॉएड स्पेस, अर्कनॉएड और पाया मेटर झिल्ली को पृथक करती है और मस्तिष्क मेरु द्रव्य से भरी होती है। सबसे बाहरी झिल्ली ड्यूरा मेटर, एक मोटी टिकाऊ झिल्ली होती है जो अर्कनॉएड झिल्ली और खोपड़ी दोनो से जुड़ी होती है।
बैक्टीरिया जनित मस्तिष्क ज्वर में, बैक्टीरिया दो मुख्य मार्गों से मस्तिष्क आवरण तक पहुंचता है: रक्त प्रवाह द्वारा या मस्तिष्क आवरण के साथ नेसल कैविटी या त्वचा के सीधे संपर्क द्वारा। अधिकतर मामलों में मस्तिष्क ज्वर रक्त प्रवाह के माध्यम से नेसल कैविटी जैसी श्लेष्म सतहों पर जीवित रहने वाले जीवों के माध्यम से आक्रमण करता है। यह अक्सर वायरस द्वारा होने वाले संक्रमणों के बाद होता है जो श्लेष्म सतह द्वारा प्रदान किये जाने वाली बाधा को तोड़ देता है। एक बार जब बैक्टीरिया रक्त प्रवाह में शामिल हो जाते हैं, सबअर्कनॉएड स्पेस में उन स्थानों में दाखिल हो जाते हैं जहां रक्त–मस्तिष्क बाधा कमजोर होती है—जैसे कोरॉएड प्लेक्सेस। मस्तिष्क ज्वर 25% नवजातों में ग्रुप बी स्टेप्टोकॉकि के कारण रक्त प्रवाह संक्रमणों से होता है; यह रूप वयस्कों में कम आम है।[1] मस्तिष्क मेरु द्रव्य का प्रत्यक्ष संदूषण, निबाह करने वाली युक्तियों, खोपड़ी के फ्रैक्चर या नैसोफैरीनक्स के संक्रमण या उस नेसल साइनस से जो सबअर्कनॉएड स्पेस (ऊपर देखिये) के साथ मार्ग का निर्माण करती है, से उभर सकता है; कभी कभार, ड्यूरा मेटर के जन्मजात दोषों को भी देखा जा सकता है।[1]
मस्तिष्क ज्वर के दौरान बड़े स्तर पर सबअर्कनॉएड स्पेस में होने वाली सूजन बैक्टीरिया संक्रमण का प्रत्यक्ष परिणाम नहीं होता है बल्कि इसे बैक्टीरिया के केन्द्रीय तंत्रिका तंत्र में प्रवेश के कारण प्रतिरक्षा तंत्र की प्रतिक्रिया का परिणाम होता है। जब बैक्टीरिया संक्रमित कोशिका झिल्ली के घटक मस्तिष्क की प्रतिरोधक कोशिकाओं (ऐस्ट्रोकाइट और माइक्रॉग्लिया) द्वारा पहचाने जाते हैं तो वे हार्मोन जैसे मध्यस्थ साइटोकाइन की बड़ी मात्रा मुक्त करके प्रतिक्रिया करते हैं जो अन्य प्रतिरक्षा कोशिकाओं को नियुक्त करते हैं और दूसरे ऊतकों को प्रतिरक्षा प्रतिक्रिया में भाग लेने के लिये उकसाते हैं। रक्त-मस्तिष्क बाधा पारगम्य हो जाती है, जिसके कारण "वैसोजेनिक" सेरेब्रेल एडीमा (रक्त केशिकाओं से द्रव्य रिसाव के कारण मस्तिष्क की सूजन) हो जाता है। श्वेत रक्त कणिकाओं की बड़ी मात्रा CSF में प्रवेश कर जाती है, जिसके कारण मस्तिष्क आवरण में सूजन हो जाती है और जिससे "इंटरटिस्शल" एडीमा (कोशिकाओं को बीच द्रव्य के कारण सूजन) हो जाता है। इसके अतिरिक्त, रक्त केशिकाओं की दीवारें अपने आप सूज जाती है (सेरेब्रल वेस्क्युलिटिस), जिससे रक्त का प्रवाह कम हो जाता है और एक तीसरे तरह का एडीमा "साइटोटॉक्सिक" एडीमा हो जाता है। सेरेब्रल एडीमा के सभी तीन प्रकार एडीमा के कारण अंतःकपालीय दाब बढ़ जाता है; जिसके साथ गंभीर संक्रमण में घटे रक्तचाप से भी सामना होता है, जिसका अर्थ है कि रक्त के लिये मस्तिष्क में प्रवेश कठिन हो जाता है, परिणामस्वरूप मस्तिष्क कोशिकाओं को ऑक्सीजन की कमी हो जाती है और वे एपाटोसिस (स्वतः कोशिका मृत्यु) चरण में प्रवेश कर जाती हैं।[1]
मान्यता यह है कि एंटीबायोटिक्स ऊपर बतायी गयी प्रक्रिया को, बैक्टीरिया संबंधित कोशिका झिल्ली उत्पादों की मात्रा को बढ़ा कर, शुरुआत में और खराब कर सकता है। विशिष्ट उपचार जैसे कि कॉर्टिकॉस्टरॉएड का उपयोग इस प्रकार की घटना के प्रति प्रतिरक्षा तंत्र की प्रतिक्रिया को निरुत्साहित करने पर लक्षित हैं।[1][4]
निदान
| Type of meningitis | Glucose | Protein | Cells |
|---|---|---|---|
| Acute bacterial | low | high | PMNs, often > 300/mm³ |
| Acute viral | normal | normal or high | mononuclear, < 300/mm³ |
| Tuberculous | low | high | mononuclear and PMNs, < 300/mm³ |
| Fungal | low | high | < 300/mm³ |
| Malignant | low | high | usually mononuclear |
रक्त परीक्षण व इमेजिंग
मस्तिष्क ज्वर से पीड़ित किसी व्यक्ति में, रक्त परीक्षण उन चिह्नों का पता लगाने के लिये किये जाते हैं जो वृद्धि (उदा. सी-रिएक्टिव प्रोटीन, संपूर्ण रक्त गणना) और रक्त कल्चरकी जानकारी देते हैं।[3][27]
मस्तिष्क ज्वर की पहचान करने करने के लिये सबसे महत्वपूर्ण परीक्षण लंबर पंचर (LP, स्पाइनल टैप) द्वारा सेरेब्रोस्पाइनल तरल का विश्लेषण है।[28] हलांकि लंबर पंचर तब प्रतिदिष्ट हो जाता है जब मस्तिष्क में कोई पिंड (ट्यूमर या फोड़ा) उपस्थित हो या अंतःकपालीय दबाव (ICP) बढ़ा हुआ हो क्योंकि इसके कारण मस्तिष्क हर्नियेशन होने की संभावना होती है। यदि कोई व्यक्ति किसी पिंड या बढ़े हुये ICP (सिर की नई चोट, एक ज्ञात प्रतिरक्षा प्रणाली, स्थानीयकृत न्यूरोलॉजिकल चिह्न या बढ़े हुये ICP के परीक्षण का साक्ष्य), एक CT या MRI स्कैन को लंबर पंचर से पहले अनुशंसित किया जाता है।[3][27][29] यह सभी वयस्क मामलों के 45% मामलों पर लागू होता है।[4] यदि LP के पहले एक CT या MRI की जरूरत पड़े या यदि LP कठिन साबित हो तो पेशेवर दिशानिर्देश सुझाव देते हैं कि उपचार में विलंब करने के लिये एंटीबायोटिक्स दी जानी चाहिये,[3] विशेष रूप से यदि यह 30 मिनट से अधिक हो।[27][29] अक्सर CT या MRI स्कैन, बाद की अवस्था में किये जाते हैं जिससे कि मस्तिष्क ज्वर की जटिलताओं का आंकलन किया जा सके।[1]
मस्तिष्क ज्वर के गंभीर रूपों में रक्त इलेक्ट्रोलाइट महत्वपूर्ण हो सकते हैं;उदाहरण के लिये हाइप्नॉट्रीमिया (रक्त में सोडियम की कमी) एक सामान्य बैक्टीरिया जनित मस्तिष्क ज्वर है, कई कारकों के संयोजन के कारण जिसमें निर्जलीकरण शामिल है, एंटीडाइयूरेटिक हार्मोन का अनुचित उत्सर्जन (SIADH) या अतिरिक्त सक्रिय अंतःशिरा तरल प्रशासन।[4][30]
लंबर पंचर

आम तौर पर एक व्यक्ति को एक करवट में लिटा कर, सेरेब्रल तरल (CSF) एकत्र करने के लिये लोकल एनेस्थीसिया लगा कर और ड्यूरल सैक (रीढ़ की हड्डी के चारों ओर लगी थैली) में एक सुई डाल कर लंबर पंचर किया जाता है। जब यह प्राप्त हो जाता है तो मैनोमीटर का उपयोग करते हुये CSF का “खुलने वाला दाब” मापा जाता है। दाब आम तौर पर 6 और 18 cm जल (cmH2O) के बीच होता है;[28] बैक्टीरिया जनित मस्तिष्क ज्वर में दाब आम तौर पर बढ़ा होता है।[3][27] In क्रिप्टोकॉकल मस्तिष्क ज्वर में अंतःकपालीय दाब काफी बढ़ा होता है।[31] तरल का आरंभिक स्वरूप संक्रमण की प्रकृति का संकेत साबित हो सकता है: धुंधला CSF संकेत करता है कि प्रोटीन, सफेद व लाल रक्त कोशिकाओं और/या बैक्टीरिया का स्तर ऊंचा है और इसलिये इसमें बैक्टीरिया जनित मस्तिष्क ज्वर हो सकता है।[3]
CSF नमूने का परीक्षण श्वेत रक्त कोशिकाओं, लाल रक्त कोशिकाओं, प्रोटीन मात्रा और ग्लूकोस स्तर की उपस्थिति व प्रकार के लिये किया जाता है।[3] नमूने की ग्राम स्टेनिंग बैक्टीरिया जनित मस्तिष्क ज्वर में बैक्टीरिया प्रदर्शित कर सकता है, लेकिन बैक्टीरिया की अनुपस्थिति बैक्टीरिया जनित मस्तिष्क ज्वर की संभावना को निष्कासित नहीं करती है क्योंकि वे सिर्फ 60% मामलों में दिखते हैं; यदि नमूना लिये जाने के पहले एंटीबायोटिक्स दिये गये थे तो यह आंकड़ा 20% तक और कम हो जाता है। ग्राम स्टेनिंग भी लिस्टेरियोसिस जैसे संक्रमणों में कम विश्वसनीय है। माइक्रोबायोलॉजिकल कल्चर का नमूना अधिक संवेदनशील होता है (यह 70–85% मामलों में जीवों को पहचान लेता है) लेकिन परिणाम उपलब्ध होने में 48 घंटे तक का समय लगता है।[3] रक्त कोशिकाओं का अधिक उपस्थित प्रकार (तालिका देखें) संकेत करता है कि क्या मस्तिष्क ज्वर बैक्टीरिया (आम तौर पर न्यूट्रोफिल-प्रीडॉमिनेंट) जनित है या वायरस (आमतौर पर लिम्फोसाइट-प्रीडॉमिनेंट) जनित,[3] हलांकि रोग की शुरुआत में यह हमेशा विश्वसनीय संकेतक नहीं होता है। कम सामान्य मामलों में स्नोफिल प्रबलता दूसरे कारणों के साथ परजीवी या फंफूंद के कारण होने का सुझाव देती है।[23]
CSF में ग्लूकोस की अधिकता आम तौर पर रक्त की तुलना में 40% ऊपर होती है। बैक्टीरिया जनित मस्तिष्क ज्वर में यह आम तौर पर कम होती है; CSF का ग्लूकोस स्तर इस कारण रक्त शर्करा (CSF ग्लूकोस सो सीरम ग्लूकोस अनुपात) से विभाजित किया जाता है। ≤0.4 का अनुपात बैक्टीरिया जनित मस्तिष्क ज्वर का संकेत हो सकता है;[28] नवजात में CSF में ग्लूकोस का स्तर आम तौर पर उच्च रहता है और 0.6 (60%) के नीचे का अनुपात असामान्य माना जाता है।[3] CSF में लैक्टेट बैक्टीरिया जनित मस्तिष्क ज्वर के होने की संभावना के उच्च स्तर को दर्शाता है, ठीक ऐसे ही श्वेत रक्त कोशिकाओं की उच्च संख्या भी।[28] यदि लैक्टेट स्तर 35 mg/dl से कम हों और व्यक्ति ने पहले कोई ऐंटीबायोटिक न लिया हो तो यह बैक्टीरिया जनित मस्तिष्क ज्वर होने की संभावना क्षीण करता है।[32]
मस्तिष्क ज्वरों के विभिन्न प्रकार की पृथक पहचान करने के लिये अन्य विशेष परीक्षण उपयोग किये जा सकते हैं। लैटेक्स एग्लुटिनेशन परीक्षण स्ट्रैप्टोकॉकस न्यूमोनिया, नीएसेरिया मेनिन्जाइटिडिस,हीमोफिलिज़ इन्फ्युएंज़ा, एस्केरीशिया कॉलिऔर ग्रुप बी स्ट्रेप्टोकॉकि के कारण होने वाले मस्तिष्क ज्वर में सकारात्मक हो सकता है; इसका नियमित प्रयोग प्रोत्साहित नहीं किया जाता है क्योंकि इसके कारण उपचार में परिवर्तन बहुत कम होते हैं लेकिन इसे तब उपयोग किया जा सकता है जब दूसरे परीक्षण निदान न कर पा रहे हों। इसी प्रकार लिम्युलस लाइसेट परीक्षण ग्राम-नकारात्मक बैक्टीरिया जनित मस्तिष्क ज्वर में सकारात्मक हो सकता है, लेकिन यह तब तक सीमित रूप से उपयोगी होता है जब तक कि अन्य परीक्षण सहायक न रहे हो।[3] पॉलीमरेस चेन रिएक्शन (PCR) एक ऐसी तकनीक है जो बैक्टीरिया के DNA के छोटे निशानों को बढ़ाने में उपयोग की जाती है, जिससे कि सेरेब्रोस्पाइनल तरल में बैक्टीरिया या वायरस DNA की उपस्थिति की पहचान की जा सके; यह एक उच्च संवेदनशीलता वाला तथा विशिष्ट परीक्षण है क्योंकि इसमें संक्रमित एजेंट के DNA के निशानों की राशि की जरूरत होती है। यह बैक्टीरिया जनित मस्तिष्क ज्वर में बैक्टीरिया की पहचान कर सकता है और वायरस जनित मस्तिष्क ज्वर (उनमे जिनको एंटेरोवायरस, हरपीस सिंप्लेक्स वायरस 2 और मम्स के लिये टीका न दिया गया हो) के विभिन्न मामलों में अंतर पता करने के लिये सहायक हो सकता है।[10] सेरोलॉजी (वायरसों के एंटीबॉडी की पहचान) वायरस जनित मस्तिष्क ज्वर में उपयोगी हो सकता है।[10] यदि ट्यूबरकलोस मस्तिष्क ज्वर का संदेह हो तो, नमूने को ज़ील नेल्सन स्टेनजिसकी संवेदनशीलता निम्न है और ट्यूबरकुलोसिस कल्चर, जिसमें अधिक समय लगता है; PCR का उपयोग बढ़ रहा है।[14] CSF पर इंडियन इंक स्टेन का उपयोग करके क्रिप्टोकॉकल मस्तिष्क ज्वर का निदान कम लागत पर किया जा सकता है; हलांकि रक्त या CSF में क्रिप्टोकॉकल एंटीजन का परीक्षण अधिक संवेदनशील होता है विशेष रूप से AIDS पीड़ित लोगों में।[33][34]
जहां पर एंटीबायोटिक्स लेने के बाद मस्तिष्क ज्वर के लक्षण होते हैं (जैसे कि प्रकल्पित साइनोसाइटिस), "आंशिक रूप से उपचारित मस्तिष्क ज्वर", एक निदानात्मक व उपचारात्मक कठिनाई है। जब ऐसा होता है तो CSF निष्कर्ष वायरस जनित मस्तिष्क ज्वर के समान दिख सकते हैं, लेकिन एंटीबायोटिक उपचार तब तक जारी रखने की आवश्यकता होती है जब तक कि वायरस संबंधी कारण (उदा. के लिये सकारात्मक एन्टेरोवायरस PCR) के निश्चित लक्षण बने रहते हैं।[10]
पोस्टमार्टम

मस्तिष्क ज्वर का निदान मृत्यु के बाद हो सकता है।पोस्टमार्टम के बाद के निष्कर्ष में आम तौर पर पाया मेटर और मस्तिष्क आवरण की परतों अर्कनॉएड की बढ़ी सूजन होती है। न्यूट्रोफिल ग्रैन्यूलोकाइट, क्रैनिएल नर्व और रीढ़ के साथ सेरेब्रोस्पाइनल तरल और मस्तिष्क के आधार की ओर बढ़ जाते हैं, जो कि पस (मवाद) द्वारा घिरे हो सकते हैं — इसी प्रकार मैनिन्जिएल केशिकायें भी।[35]
रोकथाम
मस्तिष्क ज्वर के कुछ कारणों के लिये, लंबे समय में टीकाकरण के माध्यम से या छोटी अवधि में एंटीबायोटिक्स द्वारा सुरक्षा प्रदान की जा सकती है। कुछ व्यवहार जनित उपाय भी प्रभावी हो सकते हैं।
व्यवहार जनित
बैक्टीरिया और वायरस जनित मस्तिष्क ज्वर संक्रामक हैं, हलांकि दोनो में से कोई भी आम सर्दी-ज़ुकाम या फ्लू की तरह संक्रामक नहीं है।[36] चुंबन, छीकने या किसी के खांसने से होने वाले श्वसन स्राव से निकली बूंदों के माध्यम से दोनो रोगों का संक्रमण हो सकता है लेकिन मस्तिष्क ज्वर से पीड़ित व्यक्ति द्वारा छोड़ी गयी हवा के माध्यम से ऐसा नहीं हो सकता है।[36] वायरस जनित मस्तिष्क ज्वर आम तौर पर एंटेरोवायरस के कारण होता है और सबसे आम रूप में यह मल संदूषण द्वारा फैलता है।[36] संक्रमण का जोखिम उस व्यवहार में बदलाव लाकर कम किया जा सकता है जिसके कारण संक्रमण हुआ।
टीकाकरण
1980 से कई देशों ने होमोफेलस इन्फ्युएंज़ा टाइप बी के विरुद्ध टीकाकरण को अपने नियमित बचपन टीकाकरण योजनाओं में शामिल किया है। इसने, इन देशों के युवा बच्चों में इस पैथोजन को मस्तिष्क ज्वर के कारण रूप में लगभग समाप्त कर दिया है। वे देश जहां पर रोग का बोझ उच्चतम है, वहां पर यह टीका अभी भी बहुत महंगा है।[37][38] इसी प्रकार, मम्स के विरुद्ध टीकाकरण ने मम्स संबंधी मस्तिष्क ज्वर के मामलों को काफी कम कर दिया है, जो टीकाकरण के पहले, मम्स के 15% मामलों में हुआ करते थे।[10]
समूह A, C, W135 और Y के विरुद्ध मेनिन्गोकॉकस वैक्सीन उपलब्ध है।[39] वे देश जहां पर समूह सी मस्तिष्क ज्वर के लिये टीके शुरु किये गये थे, इस पैथोजन से होने वाले मामलों में पर्याप्त कमी आयी है।[37] एक चहुमुखी टीका अब मौजूद है जो सभी चार टीकों को को जोड़ कर बना है। ACW135Y टीके के साथ टीकाकरण हज में भाग लेने के लिये जरूरी है।[40] ग्रुप बी मैनिंग्गोकॉकि के विरुद्ध टीके का निर्माण काफी कठिन साबित हुआ है, क्योंकि इसके सतह प्रोटीन की (जिसे आमतौर पर टीका बनाने के लिये उपयोग किया जाता है) प्रतिरक्षा तंत्र से प्रतिक्रिया या सामान्य मानव प्रोटीन से क्रॉस-प्रतिक्रिया, कमजोर सी होती है।[37][39] फिर भी कुछ देशों, (न्यूज़ीलैंड, क्यूबा, नॉर्वे और चिली) ने ग्रुप बी मैनिन्गोकॉकि के स्थानीय उपभेदों के विरुद्ध टीके विकसित किये हैं; कुछ ने अच्छे परिणाम दिये हैं और उनको स्थानीय टीकाकरण सूची में उपयोग किया जा रहा है।[39] अफ्रीका में अभी तक, मैनिन्गोकॉकल महामारी की रोकथाम और नियंत्रण रोग के शीघ्र पहचान पर और बाइवैलेन्ट A/C या ट्राइवैलेन्ट A/C/W135 पॉलीसैक्राइड टीके द्वारा जोखिम से जूझ रही जनसंख्या पर बड़े पैमाने पर आकस्मिक प्रतिक्रियात्मक टीकाकरण निर्भर था,[41] हलांकि MenAfriVac (मैनिन्गोकॉकल ग्रुप ए टीका) ने युवा लोगों में प्रभावशीलता का प्रदर्शन किया है और इसे संसाधन सीमित व्यवस्था में उत्पाद विकास सहयोग के मॉडल के रूप में प्रस्तुत किया गया है।[42][43]
न्यूमोकॉकल कॉन्जुगेट टीका (PCV) द्वारा स्ट्रैप्टोकॉकस निमोनिया के विरुद्ध नियमित टीकाकरण, जो कि इस पैथोजन के सात आम सेरोटाइप के विरुद्ध सक्रिय है, न्यूमोकॉकल मस्तिष्क ज्वर के मामलों को महत्वपूर्ण तरीके से कम करता है।[37][44] न्यूमोकॉकल कॉपॉलीसेक्राइड टीका, जो 23 उपभेदों को कवर करता है केवल कुछ समूहों (जैसे वे जिनके साथ तिल्ली की शल्यक्रिया, तिल्ली को शल्कक्रिया द्वारा निकाला जाना हुआ है) पर लागू किया जा रहा है; यह सभी प्राप्तकर्ताओं (जैसे छोटे बच्चे) पर महत्वपूर्ण प्रतिरोधी प्रतिक्रिया नहीं दर्शाता है।[44] बैसिलस काल्मेटे-गुएरिन द्वारा बचपन के समय में टीकाकरण को ट्यूबरकलोस मस्तिष्क ज्वर की दर में महत्वपूर्ण कमी करता देखा गया है, लेकिन वयस्कता के साथ इसकी घटती प्रभावशीलता ने एक बेहतर टीके की खोज को जरूरी कर दिया है।[37]
एंटीबायोटिक्स
लघु अवधि के एंटीबायोटिक प्रॉफिलेक्सिस रोकथाम की एक अन्य विधि है, विशेष रूप से मैनिन्गोकॉकल मस्तिष्क ज्वर के लिये। मैनिन्गोकॉकल मस्तिष्क ज्वर के मामलो में एंटीबायोटिक्स (उदाहरण के लिये रिफैम्पिसिन, सिप्रोफ्लॉक्सासिन या सेफ्ट्रियाक्सोन) के साथ नजदीकी संपर्क का रोग प्रतिरोधी उपचार स्थितियों के साथ उनके संपर्क का जोखिम कम कर सकते हैं लेकिन भविष्य में होने वाले संक्रमण जोखिमों से नहीं बचा सकते।[27][45] उपयोग किये जाने के बाद रिफैम्पिसिन के प्रति प्रतिरोध देखा गया है, जिसके कारण कुछ लोग दूसरे एजेंटों की अनुशंसा करने पर विचार करते हैं।[45] जबकि एंटीबायोटिक्स को आधारी खोपड़ी फ्रैक्चर के कारण मस्तिष्क ज्वर से पीड़ितों में इसकी रोकथाम के प्रयासों के लिये एंटीबायोटिक्स अक्सर उपयोग किया जाता है लेकिन इसके लाभप्रद या हानिकारक होने को निर्धारित करने के अपर्याप्त साक्ष्य मिले हैं।[46] यह उन पर लागू होता है जिनमें CSF लीक होता या नहीं होता है।[46]
प्रबंधन
मस्तिष्क ज्वर के साथ जीवन के साथ खतरा जुड़ा हुआ है और यदि उपचार न किया जाये तो मृत्यु दर उच्च है;[3] उपचार में देरी भी बदतर परिणामों के साथ जुड़ी हुयी है।[4] इस प्रकार, जबकि पुष्टि करने के लिये परीक्षण किये जा रहे हों तो व्यापक स्पेक्ट्रम वाली एंटीबायोटिक्स द्वारा उपचार में विलम्ब नहीं किया जाना चाहिये।[29] यदि प्राथमिक देखभाल में मैनिन्गोकॉकल रोग का शक हो तो दिशानिर्देश इस बात की अनुशंसा करते हैं कि अस्पताल में स्थानांतरित करने के पहले बेंजिलपेनिसलीन दी जाये।[7] यदि हाइपोटेंशन (निम्न रक्तचाप) या शॉक उपस्थित हैं तो अंतःशिरा तरल दिये जाने चाहिये।[29] यह जानते हुये कि मैनिन्जाइटिस कई प्रकार की आरंभिक गंभीर जटिलतायें पैदा कर सकता है, इन जटिलताओं की पहचान के लिये नियमित चिकित्सीय समीक्षा[29] और जरूरत महसूस होने पर पीड़ित व्यक्ति को गहन देखभाल इकाई की अनुशंसा की जाती है।[4]
यदि चेटना का स्तर बहुत कम हो या श्वसन विफलता के साक्ष्य हों तो जरूरत पड़ने पर मेकैनिकल वेंटिलेशन की आवश्यकता पड़ सकती है। यदि बढ़े हुये अंतःकपालीय दाब के चिह्न हो तो दाब की माप किये जाने के उपाय किये जा सकते हैं; यह सेरेब्रल परफ्यूसन दाब तथा विभिन्न उपचारों का इष्टतमीकरण करता है जिससे कि दवा (उदा. के लिये मैनिटॉल) के माध्यम से अंतः कपालीय दाब कम किया जा सके।[4] दौरों का उपचार ऐंटीकॉनवलसेंट द्वारा किया जाता है।[4] हाइड्रोकैफलस (CSF का बाधित प्रवाह) को अस्थायी या दीर्घ अवधि निकासी युक्ति जैसे कि सेरेब्रल शंट को डाले जाने की जरूरत पड़ सकती है।[4]
बैक्टीरिया जनित मस्तिष्क ज्वर
एंटीबायोटिक्स

लंबर पंचर और CSF विश्लेषण के परिणाम ज्ञात होने के पहले ही. एम्पिरिक एंटीबायोटिक्स (निश्चित निदान के बिना उपचार) तत्काल शुरु कर दी जानी चाहिये। आरंभिक उपचार का चुनाव मुख्य रूप से उस बैक्टीरिया के प्रकार पर निर्भर करता है जो किसी स्थान विशेष या जनसंख्या में मस्तिष्क ज्वर पैदा कर सकता है। उदाहरण के लिये यूनाइटेड किंगडम में एम्पिरिकल उपचार में सेफोटाक्साइम या सेफ्ट्रियाक्सोन जैसे तीसरी पीढ़ी के सेफालोस्पोरिन का उपयोग होता है।[27][29] अमरीका में स्टेप्टोकॉकि में सेफालोस्पोरिन के प्रति अधिक प्रतिरोध मिलने लगा है इसलिये आरंभिक उपचार में वैन्कोमाइसिन का संयोजन अनुशंसित किया जाता है।[3][4][27] हलांकि अकेले या संयोजन में क्लोरैम्फेनिकॉल बराबरी से काम करता है।[47]
एम्पेरिकल चिकित्सा को व्यक्ति की उम्र, सिर की चोट के पहले संक्रमण के होने, व्यक्ति के न्यूरोसर्जरी प्राप्त करने और सेरेब्रल शंट के उपस्थित होने या न होने के आधार पर चुना जा सकता है।[3] युवा बच्चों और 50 साल से अधिक की उम्र वालों में, साथ ही प्रतिरोधक क्षमता की कमी वालों में 'लिस्टेरिया मोनोकाइटोजीन्स' कवर करने के लिये एम्पिसलीन अनुशंसित की जाती है।[3][27] एक बार जब ग्राम स्टेन परिणाम उपलब्ध हो जायें और विस्तृत प्रकार के बैक्टीरिया संबंधी कारण ज्ञात हो जायें तो पैथोजन के अनुमानित समूह का सामना करने वालों को दिया जाने वाले एंटीबायोटिक को बदला जा सकता है।[3] कल्चर के परिणाम, उपलब्ध होने में अधिक समय (24–48 घंटे) लेते हैं। एक बार जब परिणाम मिल जाये तो एम्पेरिक चिकित्सा को विशिष्ट एंटीबायोटिक चिकित्सा से प्रतिस्थापित किया जा सकता है जो कि विशिष्ट कारण संबंधी जीवों और एंटीबायोटिक्स के प्रति इनकी संवेदनशीलता पर लक्षित होती है।[3] किसी एंटीबायोटिक को मस्तिष्क ज्वर के लिये प्रभावी होने के लिये, उसे न सिर्फ पैथोजेनिक बैक्टीरियम के विरुद्ध प्रभावी होना चाहिये लेकिन साथ ही उसे मस्तिष्क आवरण में पर्याप्त मात्रा में पहुंचना चाहिये; कुछ एंटीबायोटिक्स की भेदन क्षमता अपर्याप्त होती है और इसलिये उनका मस्तिष्क ज्वर में कम उपयोग होता है। मस्तिष्क ज्वर में उपयोग किये जाने वाले अधिकतर एंटीबायोटिक्स को चिकित्सीय परीक्षणों में मस्तिष्क ज्वर से पीड़ित लोगों पर प्रत्यक्ष रूप से परीक्षण नहीं किया गया है। बल्कि अधिकतर प्रासंगिक ज्ञान प्रयोगशाला अध्ययनों में खरगोशों पर अर्जित किया गया है।[3] ट्यूबरक्यूलस मस्तिष्क ज्वर को एंटीबायोटिक्स द्वारा लंबे उपचार की जरूरत पड़ती है। जबकि फेफड़ों के ट्यूबरकलोसिस का आम तौर पर 6 माह तक उपचार किया जाता है वहीं ट्यूबरक्यूलस मस्तिष्क ज्वर से पीड़ित लोगों को एक साल या अधिक समय तक उपचार की जरूरत पड़ती है।[14]
स्टेरॉयड
कॉर्टिकॉस्टरॉयड (आमतौर पर डेक्सामीथेनोस) के साथ सहायक उपचार ने कुछ लाभ दर्शाये हैं जैसे कि बहरेपन में कमीं[48] और बेहतर लघु अवधि न्यूरोलॉजिकल परिणाम[49] लेकिन ऐसे किशोरों और वयस्कों में जो ऐसे उच्च आय देश से आते हैं जहां पर AIDS की दर कम है।[50] कुछ शोधों में पता चला है कि मृत्यु की दर कम होती है[50] जबकि अन्य में ऐसा नहीं पता चला है।[49] वे उन लोगों में लाभदायक दिखते हैं जिनको ट्यूबरकलोसिस मस्तिष्क ज्वर हुआ हो, कम से कम वे मामले जिनमें HIV नकारात्मक रहा है।[51]
इसलिये पेशेवर दिशानिर्देश अनुशंसित करते हैं कि पहली एंटीबायोटिक्स की पहली खुराक के ठीक पहले डेक्सामेथासोन या एक ऐसे ही कॉर्टिकॉस्टिरॉयड दी जाये और इसे चार दिनों तक जारी रखा जाये।[27][29] ऐसा करने से न्यूमोकॉकल मस्तिष्क ज्वर से पीड़ित लोगो तक ही उपचार के लाभ सीमित रहते हैं, कुछ दिशानिर्देश सुझाव देते हैं कि डेक्सामेथासोन को तब रोक दिया जाना चाहिये यदि मस्तिष्क ज्वर के लिये अन्य कारण पहचाने जायें।[3][27] संभावित व्यवस्था अतिसक्रिय सूजन का दमन है।[52]
वयस्कों की अपेक्षा बच्चों में सहायक कॉर्टिकॉस्टरॉयड की भिन्न भूमिका है। हलांकि उच्च आय देशों के वयस्कों और बच्चों में कॉर्टिकॉस्टरॉएड के लाभ दिखते हैं, लेकिन कम आय वाले देशों में बच्चों पर इसके उपयोग को साक्ष्य का समर्थन नहीं मिलता है; इस अंतर का कारण स्पष्ट नहीं है।[49] यहां तक कि उच्च आय देशों में, कॉर्टिकॉस्टरॉयड के लाभ केवल तब दिखते हैं जब वे ऐंटीबायोटिक्स की पहली खुराक से पहले दिये जाते हैं और यह वहां पर सबसे अधिक दिखते हैं जहां पर एच. इंफ्लुएंजा मस्तिष्क ज्वर के मामले हों,[3][53] जिसका होना Hib टीके की शुरुआत के बाद नाटकीय रूप से घट गया है। इस प्रकार, कॉर्टिकॉस्टिरॉयड को शिशुओं को होने वाले मस्तिष्क ज्वर के अनुशंसित किया जाता है यदि इसका कारण एच. इंफ्लुएंजा है और यदि इसको एंटीबायोटिक्स की पहली खुराक के पहले दिया जाये; अन्य उपयोग विवादित हैं।[3]
वायरस जनित मस्तिष्क ज्वर
वायरस जनित मस्तिष्क ज्वर के लिये आमतौर पर केवल सहायक चिकित्सा की आवश्यकता होती है; मस्तिष्क ज्वर के लिये जिम्मेदार अधिकतर वायरस विशिष्ट उपचार के अनुगामी नहीं होते हैं। वायरस जनित मस्तिष्क ज्वर, बैक्टीरिया जनित मस्तिष्क ज्वर से अधिक सौम्य मार्ग पर चलता है। हरपीस सिम्प्लेक्स वायरस और वैरिसेला ज़ोस्टर वायरस, एसीक्लोवर जैसी वायरस रोधी दवाओं के प्रति प्रतिक्रिया दे सकते हैं, लेकिन ऐसे चिकित्सीय परीक्षण नहीं हुये हैं जो इस बात को विशिष्ट रूप से संबोधित करते हों कि क्या यह उपचार प्रभावी है।[10] वायरस जनित मस्तिष्क ज्वर के सौम्य मामलों का तरल, पूर्ण आराम और एन्लजेसिक जैसे पारंपरिक उपायों द्वारा घर पर उपचार किया जा सकता है।[54]
फफूंद जनित मस्तिष्क ज्वर
फफूंद जनित मस्तिष्क ज्वर, जैसे क्रिप्टोकॉकल मस्तिष्क ज्वर का ऐम्फोटेरिसिन बी और फ्लूसाइटोसिन जैसे फफूंद रोधी की उच्च खुराक का दीर्घ अवधि उपचार दिया जाता है।[33][55] फफूंद जनित मस्तिष्क ज्वर में अंतः कपालीय दाब आम है और दाब को मुक्त करने के लिये नियमित लंबर पंचर (आदर्श रूप में रोज) अनुशंसित किया जाता है,[33] या वैकल्पिक रूप से लंबर ड्रेन भी किया जा सकता है।[31]
रोग निदान

██ no data ██ <10 ██ 10-25 ██ 25-50 ██ 50-75 ██ 75-100 ██ 100-200 | ██ 200-300 ██ 300-400 ██ 400-500 ██ 500-750 ██ 750–1000 ██ >1000 |
अनुपचारित बैक्टीरिया जनित मस्तिष्क ज्वर लगभग हर बार प्राणघातक होता है। इसके विपरीत वायरस जनित मस्तिष्क ज्वर शायद ही कभी प्राणघातक होता हो। उपचार के साथ, बैक्टीरिया जनित मस्तिष्क ज्वर से मृत्युदर (मृत्यु का जोखिम), व्यक्ति की उम्र और अंतर्निहित कारकों पर निर्भर करती है। नवजातों में से 20–30% बैक्टीरिया जनित मस्तिष्क ज्वर के कारण मर सकते हैं। यह जोखिम बड़े बच्चों में काफी कम होता है, जिनमें मृत्यु दर लगभग 2% है लेकिन वयस्कों में बढ़ कर यह लगभग 19–37% तक हो जाता है।[1][4]मृत्यु का जोखिम उम्र के अलावा भिन्न-भिन्न अन्य कारकों द्वारा भी तय होता है जैसे कि पैथोजन और सेरेब्रोस्पाइनल तरल से पैथोजन को मुक्त करने में लगा समय,[1] सामान्यीकृत बीमारी की गंभीरता, चेतना का घटा स्तर या CSF में श्वेत रक्त कोशिकाओं की असमान्य रूप से कम संख्या।[4] एच. फ्लुएंजा और ग्रुप बी स्टेप्टोकॉकि, कॉलिफॉर्म्स और एस. न्यूमोनिया द्वारा हुये मामलों की तुलना में मैनिन्गोकॉकि द्वारा हुये मस्तिष्क ज्वर में रोग निदान बेहतर होता है।[1] वयस्कों में, मैनिन्गोकॉकल मस्तिष्क ज्वर में न्यूमोकॉकल रोग की तुलना में मुत्यु दर कम (3–7%) होती है।[4]
बच्चों में कई सारी संभावित असमर्थतायें हो सकती हैं जो स्नायु तंत्र की क्षति के परिणाम स्वरूप हो सकती हैं जिनमें सेंसिन्यूरल श्रवण हानि, मिर्गी, सीखना और व्यवहारजनक कठिनाइयां तथा साथ ही घटी बुद्धिमत्ता शामिल है।[1] यह जीवित बच गये लगभग 15% लोगों में होती है।[1] सुनने से संबधित हानियों में से कुछ ठीक भी हो जाती हैं।[57]वयस्कों में, सभी मामलों में से 66% मामले बिना किसी असमर्थता के उभरते हैं। मुख्य समस्यायें बहरापन (14% मामलों में) और संज्ञानात्मक हानि (10% मामलो में) हैं।[4]
महामारी विज्ञान

हलांकि मस्तिष्क ज्वर बहुत से देशों में एक सूचनीय रोग है, सटीक घटना दर अज्ञात है।[10] पश्चिमी देशों में बैक्टीरिया जनित मस्तिष्क ज्वर की वार्षिक दर 1,00,000 में 3 लोगों की है। जनसंख्या-विस्तृत अध्ययनों ने प्रदर्शित किया है कि वायरस जनित मस्तिष्क ज्वर अधिक आम है जिसकी दर 1,00,000 व्यक्तियों में 10.9 प्रति वर्ष है और यह अक्सर गर्मियों में होता है। ब्राजील में बैक्टीरिया जनित मस्तिष्क ज्वर की वार्षिक दर 1,00,000 व्यक्तियों में 45.8 प्रति वर्ष है।[6] उप-सहारा अफ्रीका एक शताब्दी से मैनिन्गोकॉकल मस्तिष्क ज्वर की बड़ी महामारी से पीड़ित रहा है,[58] जिसके कारण इसको "मस्तिष्क ज्वर पट्टी" कहा जाता है। महामारी आमतौर पर सूखे मौसम (दिसम्बर से जून) में होती है और महामारी की लहर दो से तीन साल तक बनी रह सकती है, जो बारिश के मौसमों के हस्तक्षेप से समाप्त सी हो जाती है।[59] इस क्षेत्र में आक्रमण की दर 1,00,000 व्यक्तियों पर 100-800 व्यक्तियों की होती है,[60] इसकी चिकित्सीय देखभाल बेहद खराब होती है। ये मामले मुख्य रूप से मौनिन्गोकॉकि द्वारा जनित होते हैं।[6] सम्पूर्ण क्षेत्र में 1996-97 में सबसे बड़ा महामारी का प्रकोप दर्ज किया गया था, जिसमें 2,50,000 मामले हुये थे और 25,000 लोगों की मृत्यु हो गयी थी।[61]
मैनिन्गोकॉकल रोग महामारी के रूप में उन क्षेत्रों में होता है जहां पर बहुत सारे लोग पहली बार एक साथ रहते हैं जैसे, लामबंदी के समय फौज की बैरक, कॉलेज कैंपस[1] और वार्षिक हज तीर्थयात्रा।[40] हलांकि अफ्रीका में महामारी चक्र का पैटर्न ठीक तरह से नहीं समझा गया है फिर भी मस्तिष्क ज्वर पट्टी में महामारी का विकास कई सारे कारकों से जुड़ा है। इनमें शामिल हैं: चिकित्सीय परिस्थितियां (जनसंख्या की प्रतिरक्षी संवेदनशीलता), जनसांख्यिकीय परिस्थितियां (यात्रा तथा बड़ा जनसंख्या प्रतिस्थापन), आमाजिक-आर्थिक परिस्थितियां (भीड़भाड़ और रहने की बुरी परिस्थितियां), मौसम संबंधी परिस्थितियां (सूखा और धूल भरे अंधड़) और समवर्ती संक्रमण (गंभीर श्वसन संबंधी संक्रमण)।[60]
बैक्टीरिया जनित मस्तिष्क ज्वर के लिये कारकों के स्थानीय वितरण में महत्वपूर्ण अंतर देखे होते हैं। उदाहरण के लिये, जबकि यूरोप में रोग के लिये अधिकतर “एन. मस्तिष्क ज्वर” ग्रुप बी व सी जिम्मेदार होता है तो एशिया व अफ्रीका में ग्रुप ए जिम्मेदार होता है, जहां पर यह मस्तिष्क ज्वर पट्टी में मुख्य महामारियों का कारक है जो कि समस्त दस्तावेजित मेनिन्गोकॉकल मस्तिष्क ज्वर मामलों का लगभग 80 से 85% होता है।[60]
इतिहास
कुछ लोग सुझाव देते हैं कि हिप्पोक्रेटस को मस्तिष्क ज्वर की मौजूदगी का एहसास हो गया था,[6] और ऐसा लगता है कि मैनिन्गिसम पुर्नजागरण-पूर्व चिकित्सकों जैसे अविसेन्ना का पता था।[62] ट्यूबरक्यूलस मस्तिष्क ज्वर का वर्णन जिसे उस समय "मस्तिष्क में ड्रॉप्सी" कहा जाता था, उसे अक्सर 1768 में जारी होने वाली मरणोपरांत रिपोर्ट में एडिनबर्ग के चिकित्सक सर रॉबर्ट व्हाइट के योगदान के रूप में जाना जाता है, हलांकि ट्यूबरक्युलोसिस और इसके पैथोजन के बीच संबंध अगली शताब्दी तक नहीं सिद्ध हो पाये थे।[62][63]
ऐसा लगता है कि महामारी मस्तिष्क ज्वर तुलनात्मक रूप से एक नया तथ्य है।[64] पहला प्रमुख प्रकोप जो दर्ज किया गया था वह 1805 में जेनेवा में था।[64][65] यूरोप तथा यूनाइटेड स्टेट्स में इसके तुरंत बाद कई अन्य महामारियां बतायी गयीं और अफ्रीका में किसी महामारी की पहली रिपोर्ट 1840 में जारी हुयी। अफ्रीकी महामारी 20वीं शताब्दी में अधिक आम हो गयी, जिसमें 1905-08 में नाइजीरिया और घाना में फैली महामारी से शुरुआत हुयी।[64]
बैक्टीरिया जनित संक्रमण पर पहली रिपोर्ट जिसमें मस्तिष्क ज्वर अंतर्निहित था, ऑस्ट्रिया के बैक्टीरिया विज्ञानी एंटॉन वाइक्सलबाउम की थी, जिसने 1887 में “मैनिन्गोकॉकस” की व्याख्या की थी। [66] शुरुआती रिपोर्यों में मस्तिष्क ज्वर के कारण होने वाली मौतों का आंकड़ा काफी उच्च था (लगभग 90%)। 1906 में घोड़ों में एंटीसेरम उत्पन्न किया गया; इसको अमरीकी वैज्ञानिक सिमॉन फ्लेक्सनर द्वारा और अधिक विकसित किया गया और जिसने मैनिन्गोकॉकल रोग से होने वाली मौतों में काफी कमी कर दी।[67][68] 1944 में पेनिसलीन को मस्तिष्क ज्वर में प्रभावी कहा गया।[69] The introduction in the late 20th century of हेमोफाइलस टीके को बीसवी शताब्दी के अंत में जारी करने से इस पैथोजन से जुड़े मस्तिष्क ज्वर के मामलों में काफी कमी आयी,[38] और 2002 में इस बात के साक्ष्य सामने आये कि स्टीरॉयड द्वारा उपचार करने से बैक्टीरिया जनित मस्तिष्क ज्वर का निदान बेहतर हो सकता है।[52][49][68]
इन्हें भी देखें
- मस्तिष्कशोथ (इन्सेफेलाइटिस))
बाहरी कड़ियाँ
सन्दर्भ
- ↑ अ आ इ ई उ ऊ ए ऐ ओ औ क ख ग घ ङ च छ ज झ ञ ट ठ ड ढ ण त Sáez-Llorens X, McCracken GH (2003). "Bacterial meningitis in children". Lancet. 361 (9375): 2139–48. PMID 12826449. डीओआइ:10.1016/S0140-6736(03)13693-8. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ अ आ इ ई उ ऊ ए Ginsberg L (2004). "Difficult and recurrent meningitis" (PDF). Journal of Neurology, Neurosurgery, and Psychiatry. 75 Suppl 1 (90001): i16–21. PMID 14978146. डीओआइ:10.1136/jnnp.2003.034272. पी॰एम॰सी॰ 1765649. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ अ आ इ ई उ ऊ ए ऐ ओ औ क ख ग घ ङ च छ ज झ ञ ट ठ ड ढ ण त थ द Tunkel AR; Hartman BJ; Kaplan SL; एवं अन्य (2004). "Practice guidelines for the management of bacterial meningitis" (PDF). Clinical Infectious Diseases. 39 (9): 1267–84. PMID 15494903. डीओआइ:10.1086/425368. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद); नामालूम प्राचल|author-separator=की उपेक्षा की गयी (मदद) - ↑ अ आ इ ई उ ऊ ए ऐ ओ औ क ख ग घ ङ च छ ज झ ञ ट van de Beek D, de Gans J, Tunkel AR, Wijdicks EF (2006). "Community-acquired bacterial meningitis in adults". The New England Journal of Medicine. 354 (1): 44–53. PMID 16394301. डीओआइ:10.1056/NEJMra052116. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ अ आ van de Beek D, de Gans J, Spanjaard L, Weisfelt M, Reitsma JB, Vermeulen M (2004). "Clinical features and prognostic factors in adults with bacterial meningitis" (PDF). The New England Journal of Medicine. 351 (18): 1849–59. PMID 15509818. डीओआइ:10.1056/NEJMoa040845. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ अ आ इ ई उ ऊ ए ऐ ओ औ क Attia J, Hatala R, Cook DJ, Wong JG (1999). "The rational clinical examination. Does this adult patient have acute meningitis?". Journal of the American Medical Association. 282 (2): 175–81. PMID 10411200. डीओआइ:10.1001/jama.282.2.175. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ अ आ इ Theilen U, Wilson L, Wilson G, Beattie JO, Qureshi S, Simpson D (2008). "Management of invasive meningococcal disease in children and young people: Summary of SIGN guidelines". BMJ (Clinical research ed.). 336 (7657): 1367–70. PMID 18556318. डीओआइ:10.1136/bmj.a129. पी॰एम॰सी॰ 2427067. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Management of invasive meningococcal disease in children and young people (PDF). Edinburgh: Scottish Intercollegiate Guidelines Network (SIGN). 2008. आई॰ऍस॰बी॰ऍन॰ 978-1-905813-31-5. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Thomas KE, Hasbun R, Jekel J, Quagliarello VJ (2002). "The diagnostic accuracy of Kernig's sign, [[Brudzinski neck sign]], and nuchal rigidity in adults with suspected meningitis" (PDF). Clinical Infectious Diseases. 35 (1): 46–52. PMID 12060874. डीओआइ:10.1086/340979. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद); URL–wikilink conflict (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ अ आ इ ई उ ऊ ए ऐ Logan SA, MacMahon E (2008). "Viral meningitis". BMJ (Clinical research ed.). 336 (7634): 36–40. PMID 18174598. डीओआइ:10.1136/bmj.39409.673657.AE. पी॰एम॰सी॰ 2174764. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Varon J, Chen K, Sternbach GL (1998). "Rupert Waterhouse and Carl Friderichsen: adrenal apoplexy". J Emerg Med. 16 (4): 643–7. PMID 9696186. डीओआइ:10.1016/S0736-4679(98)00061-4.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Hsu HE; Shutt KA; Moore MR; एवं अन्य (2009). "Effect of pneumococcal conjugate vaccine on pneumococcal meningitis". N Engl J Med. 360 (3): 244–256. PMID 19144940. डीओआइ:10.1056/NEJMoa0800836. नामालूम प्राचल
|author-separator=की उपेक्षा की गयी (मदद) - ↑ Wei BP, Robins-Browne RM, Shepherd RK, Clark GM, O'Leary SJ (2008). "Can we prevent cochlear implant recipients from developing pneumococcal meningitis?" (PDF). Clin. Infect. Dis. 46 (1): e1–7. PMID 18171202. डीओआइ:10.1086/524083. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ अ आ इ Thwaites G, Chau TT, Mai NT, Drobniewski F, McAdam K, Farrar J (2000). "Tuberculous meningitis" (PDF). Journal of Neurology, Neurosurgery, and Psychiatry. 68 (3): 289–99. PMID 10675209. डीओआइ:10.1136/jnnp.68.3.289. पी॰एम॰सी॰ 1736815. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ अ आ इ ई उ Tebruegge M, Curtis N (2008). "Epidemiology, etiology, pathogenesis, and diagnosis of recurrent bacterial meningitis". Clinical Microbiology Reviews. 21 (3): 519–37. PMID 18625686. डीओआइ:10.1128/CMR.00009-08. पी॰एम॰सी॰ 2493086. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Raman Sharma R (2010). "Fungal infections of the nervous system: current perspective and controversies in management". International journal of surgery (London, England). 8 (8): 591–601. PMID 20673817. डीओआइ:10.1016/j.ijsu.2010.07.293.
- ↑ अ आ इ Sirven JI, Malamut BL (2008). Clinical neurology of the older adult (2nd ed. संस्करण). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. पृ॰ 439. आई॰ऍस॰बी॰ऍन॰ 9780781769471.सीएस1 रखरखाव: फालतू पाठ (link)
- ↑ Honda H, Warren DK (2009 Sep). "Central nervous system infections: meningitis and brain abscess". Infectious disease clinics of North America. 23 (3): 609–23. PMID 19665086. डीओआइ:10.1016/j.idc.2009.04.009.
|date=में तिथि प्राचल का मान जाँचें (मदद) - ↑ Kauffman CA, Pappas PG, Patterson TF (19 अक्टूबर 2012). "Fungal infections associated with contaminated methyprednisolone injections—preliminary report". New England Journal of Medicine. Online first. डीओआइ:10.1056/NEJMra1212617.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Kauffman CA, Pappas PG, Sobel JD, Dismukes WE. Essentials of clinical mycology (2nd ed. संस्करण). New York: स्प्रिंगर. पृ॰ 77. आई॰ऍस॰बी॰ऍन॰ 9781441966391.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) सीएस1 रखरखाव: फालतू पाठ (link)
- ↑ Kauffman CA, Pappas PG, Sobel JD, Dismukes WE. Essentials of clinical mycology (2nd ed. संस्करण). New York: स्प्रिंगर. पृ॰ 31. आई॰ऍस॰बी॰ऍन॰ 9781441966391.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) सीएस1 रखरखाव: फालतू पाठ (link)
- ↑ Park, Benjamin J (1 फ़रवरी 2009). "Estimation of the current global burden of cryptococcal meningitis among persons living with HIV/AIDS". AIDS. 23 (4): 525–530. PMID 19182676. डीओआइ:10.1097/QAD.0b013e328322ffac. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद)सीएस1 रखरखाव: तिथि और वर्ष (link) - ↑ अ आ Graeff-Teixeira C, da Silva AC, Yoshimura K (2009). "Update on eosinophilic meningoencephalitis and its clinical relevance" (PDF). Clinical Microbiology Reviews. 22 (2): 322–48. PMID 19366917. डीओआइ:10.1128/CMR.00044-08. पी॰एम॰सी॰ 2668237. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Gleissner B, Chamberlain MC (2006). "Neoplastic meningitis". Lancet Neurol. 5 (5): 443–52. PMID 16632315. डीओआइ:10.1016/S1474-4422(06)70443-4. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Moris G, Garcia-Monco JC (1999). "The Challenge of Drug-Induced Aseptic Meningitis" (PDF). Archives of Internal Medicine. 159 (11): 1185–94. PMID 10371226. डीओआइ:10.1001/archinte.159.11.1185. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Provan, Drew (2005). Oxford Handbook of Clinical and Laboratory Investigation. Oxford: Oxford University Press. आई॰ऍस॰बी॰ऍन॰ 0-19-856663-8. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद) - ↑ अ आ इ ई उ ऊ ए ऐ ओ औ Chaudhuri A; Martinez–Martin P; Martin PM; एवं अन्य (2008). "EFNS guideline on the management of community-acquired bacterial meningitis: report of an EFNS Task Force on acute bacterial meningitis in older children and adults". European Journal of Neurolology. 15 (7): 649–59. PMID 18582342. डीओआइ:10.1111/j.1468-1331.2008.02193.x. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद); नामालूम प्राचल|author-separator=की उपेक्षा की गयी (मदद) - ↑ अ आ इ ई Straus SE, Thorpe KE, Holroyd-Leduc J (2006). "How do I perform a lumbar puncture and analyze the results to diagnose bacterial meningitis?". Journal of the American Medical Association. 296 (16): 2012–22. PMID 17062865. डीओआइ:10.1001/jama.296.16.2012. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ अ आ इ ई उ ऊ ए Heyderman RS, Lambert HP, O'Sullivan I, Stuart JM, Taylor BL, Wall RA (2003). "Early management of suspected bacterial meningitis and meningococcal septicaemia in adults" (PDF). The Journal of infection. 46 (2): 75–7. PMID 12634067. डीओआइ:10.1053/jinf.2002.1110. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) – formal guideline at British Infection Society & UK Meningitis Research Trust (2004). "Early management of suspected meningitis and meningococcal septicaemia in immunocompetent adults". British Infection Society Guidelines. अभिगमन तिथि 2008-10-19. नामालूम प्राचल|month=की उपेक्षा की गयी (मदद) - ↑ Maconochie I, Baumer H, Stewart ME (2008). MacOnochie, Ian K (संपा॰). "Fluid therapy for acute bacterial meningitis". Cochrane Database of Systematic Reviews (1): CD004786. PMID 18254060. डीओआइ:10.1002/14651858.CD004786.pub3. CD004786.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ अ आ Perfect JR, Dismukes WE, Dromer F; एवं अन्य (2010). "Clinical practice guidelines for the management of cryptococcal disease: 2010 update by the infectious diseases society of america". Clinical Infectious Diseases. 50 (3): 291–322. PMID 20047480. डीओआइ:10.1086/649858. Explicit use of et al. in:
|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Sakushima, K (2011 Apr). "Diagnostic accuracy of cerebrospinal fluid lactate for differentiating bacterial meningitis from aseptic meningitis: a meta-analysis". The Journal of infection. 62 (4): 255–62. PMID 21382412. डीओआइ:10.1016/j.jinf.2011.02.010. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद);|date=में तिथि प्राचल का मान जाँचें (मदद) - ↑ अ आ इ Bicanic T, Harrison TS (2004). "Cryptococcal meningitis" (PDF). British Medical Bulletin. 72 (1): 99–118. PMID 15838017. डीओआइ:10.1093/bmb/ldh043.
- ↑ Sloan D, Dlamini S, Paul N, Dedicoat M (2008). Sloan, Derek (संपा॰). "Treatment of acute cryptococcal meningitis in HIV infected adults, with an emphasis on resource-limited settings". Cochrane Database of Systematic Reviews (4): CD005647. PMID 18843697. डीओआइ:10.1002/14651858.CD005647.pub2. CD005647.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Warrell DA, Farrar JJ, Crook DWM (2003). "24.14.1 Bacterial meningitis". Oxford Textbook of Medicine Volume 3 (Fourth संस्करण). Oxford University Press. पपृ॰ 1115–29. आई॰ऍस॰बी॰ऍन॰ 0-19-852787-X.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ अ आ इ "CDC – Meningitis: Transmission". Centers for Disease Control and Prevention (CDC). August 6, 2009. अभिगमन तिथि 18 जून 2011.
- ↑ अ आ इ ई उ Segal S, Pollard AJ (2004). "Vaccines against bacterial meningitis" (PDF). British Medical Bulletin. 72 (1): 65–81. PMID 15802609. डीओआइ:10.1093/bmb/ldh041.
- ↑ अ आ Peltola H (2000). "Worldwide Haemophilus influenzae type b disease at the beginning of the 21st century: global analysis of the disease burden 25 years after the use of the polysaccharide vaccine and a decade after the advent of conjugates" (PDF). Clinical Microbiology Reviews. 13 (2): 302–17. PMID 10756001. डीओआइ:10.1128/CMR.13.2.302-317.2000. पी॰एम॰सी॰ 100154. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ अ आ इ Harrison LH (2006). "Prospects for vaccine prevention of meningococcal infection" (PDF). Clinical Microbiology Reviews. 19 (1): 142–64. PMID 16418528. डीओआइ:10.1128/CMR.19.1.142-164.2006. पी॰एम॰सी॰ 1360272. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ अ आ Wilder-Smith A (2007). "Meningococcal vaccine in travelers". Current Opinion in Infectious Diseases. 20 (5): 454–60. PMID 17762777. डीओआइ:10.1097/QCO.0b013e3282a64700. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ WHO (2000). "Detecting meningococcal meningitis epidemics in highly-endemic African countries" (PDF). Weekly Epidemiological Record. 75 (38): 306–9. PMID 11045076. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Bishai, DM (2011 Jun). "Product development partnerships hit their stride: lessons from developing a meningitis vaccine for Africa". Health affairs (Project Hope). 30 (6): 1058–64. PMID 21653957. डीओआइ:10.1377/hlthaff.2011.0295. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद);|date=में तिथि प्राचल का मान जाँचें (मदद) - ↑ Marc LaForce, F (2009 Jun 24). "Epidemic meningitis due to Group A Neisseria meningitidis in the African meningitis belt: a persistent problem with an imminent solution". Vaccine. 27 Suppl 2: B13-9. PMID 19477559. डीओआइ:10.1016/j.vaccine.2009.04.062. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद);|date=में तिथि प्राचल का मान जाँचें (मदद) - ↑ अ आ Weisfelt M, de Gans J, van der Poll T, van de Beek D (2006). "Pneumococcal meningitis in adults: new approaches to management and prevention". Lancet Neurol. 5 (4): 332–42. PMID 16545750. डीओआइ:10.1016/S1474-4422(06)70409-4. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ अ आ Zalmanovici Trestioreanu, A (2011 Aug 10). "Antibiotics for preventing meningococcal infections". Cochrane database of systematic reviews (Online) (8): CD004785. PMID 21833949. डीओआइ:10.1002/14651858.CD004785.pub4. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद);|date=में तिथि प्राचल का मान जाँचें (मदद) - ↑ अ आ Ratilal, BO (2011 Aug 10). "Antibiotic prophylaxis for preventing meningitis in patients with basilar skull fractures". Cochrane database of systematic reviews (Online) (8): CD004884. PMID 21833952. डीओआइ:10.1002/14651858.CD004884.pub3. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद);|date=में तिथि प्राचल का मान जाँचें (मदद) - ↑ Prasad, K (2007 Oct 17). "Third generation cephalosporins versus conventional antibiotics for treating acute bacterial meningitis". Cochrane database of systematic reviews (Online) (4): CD001832. PMID 17943757. डीओआइ:10.1002/14651858.CD001832.pub3. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद);|date=में तिथि प्राचल का मान जाँचें (मदद) - ↑ लुआ त्रुटि Module:Citation/CS1/Utilities में पंक्ति 60 पर: bad argument #1 to 'message.newRawMessage' (string expected, got nil)।
- ↑ अ आ इ ई Brouwer MC, McIntyre P, de Gans J, Prasad K, van de Beek D (2010). Van De Beek, Diederik (संपा॰). "Corticosteroids for acute bacterial meningitis". Cochrane Database of Systematic Reviews (9): CD004405. PMID 20824838. डीओआइ:10.1002/14651858.CD004405.pub3. CD004405.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ अ आ Assiri AM, Alasmari FA, Zimmerman VA, Baddour LM, Erwin PJ, Tleyjeh IM (2009). "Corticosteroid administration and outcome of adolescents and adults with acute bacterial meningitis: a meta-analysis". Mayo Clin. Proc. 84 (5): 403–9. PMID 19411436. डीओआइ:10.4065/84.5.403. पी॰एम॰सी॰ 2676122. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Prasad, K (2008 Jan 23). "Corticosteroids for managing tuberculous meningitis". Cochrane database of systematic reviews (Online) (1): CD002244. PMID 18254003. डीओआइ:10.1002/14651858.CD002244.pub3. नामालूम प्राचल
|coauthors=की उपेक्षा की गयी (|author=सुझावित है) (मदद);|date=में तिथि प्राचल का मान जाँचें (मदद) - ↑ अ आ de Gans J, van de Beek D (2002). "Dexamethasone in adults with bacterial meningitis" (PDF). The New England Journal of Medicine. 347 (20): 1549–56. PMID 12432041. डीओआइ:10.1056/NEJMoa021334. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ McIntyre PB; Berkey CS; King SM; एवं अन्य (1997). "Dexamethasone as adjunctive therapy in bacterial meningitis. A meta-analysis of randomized clinical trials since 1988". Journal of the American Medical Association. 278 (11): 925–31. PMID 9302246. डीओआइ:10.1001/jama.1997.03550110063038. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद); नामालूम प्राचल|author-separator=की उपेक्षा की गयी (मदद) - ↑ "Meningitis and Encephalitis Fact Sheet". National Institute of Neurological Disorders and Stroke (NINDS). 2007-12-11. अभिगमन तिथि 2009-04-27.
- ↑ Gottfredsson M, Perfect JR (2000). "Fungal meningitis". Seminars in Neurology. 20 (3): 307–22. PMID 11051295. डीओआइ:10.1055/s-2000-9394.
- ↑ "Mortality and Burden of Disease Estimates for WHO Member States in 2002" (xls). World Health Organization (WHO). 2002.
- ↑ Richardson MP, Reid A, Tarlow MJ, Rudd PT (1997). "Hearing loss during bacterial meningitis" (PDF). Archives of Disease in Childhood. 76 (2): 134–38. PMID 9068303. डीओआइ:10.1136/adc.76.2.134. पी॰एम॰सी॰ 1717058. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Lapeyssonnie L (1963). "Cerebrospinal meningitis in Africa". Bulletin of the World Health Organization. 28: SUPPL:1–114. PMID 14259333. पी॰एम॰सी॰ 2554630.
- ↑ Greenwood B (1999). "Manson Lecture. Meningococcal meningitis in Africa". Trans. R. Soc. Trop. Med. Hyg. 93 (4): 341–53. PMID 10674069. डीओआइ:10.1016/S0035-9203(99)90106-2.
- ↑ अ आ इ World Health Organization (1998). Control of epidemic meningococcal disease, practical guidelines, 2nd edition, WHO/EMC/BA/98 (PDF). 3. पपृ॰ 1–83.
- ↑ WHO (2003). "Detecting meningococcal meningitis epidemics in highly-endemic African countries" (PDF). Weekly Epidemiological Record. 78 (33): 294–6. PMID 14509123.
- ↑ अ आ Arthur Earl Walker, Edward R. Laws, George B. Udvarhelyi (1998). "Infections and inflammatory involvement of the CNS". The Genesis of Neuroscience. Thieme. पपृ॰ 219–21. आई॰ऍस॰बी॰ऍन॰ 1-879284-62-6.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Whytt R (1768). Observations on the Dropsy in the Brain. Edinburgh: J. Balfour.
- ↑ अ आ इ Greenwood B (2006). "100 years of epidemic meningitis in West Africa – has anything changed?" (PDF). Tropical Medicine & International health: TM & IH. 11 (6): 773–80. PMID 16771997. डीओआइ:10.1111/j.1365-3156.2006.01639.x. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Vieusseux G (1806). "Mémoire sur le Maladie qui a regne à Génève au printemps de 1805". Journal de Médecine, de Chirurgie et de Pharmacologie (Bruxelles) (French में). 11: 50–53.सीएस1 रखरखाव: नामालूम भाषा (link)
- ↑ Weichselbaum A (1887). "Ueber die Aetiologie der akuten Meningitis cerebro-spinalis". Fortschrift der Medizin (German में). 5: 573–583.सीएस1 रखरखाव: नामालूम भाषा (link)
- ↑ Flexner S (1913). "The results of the serum treatment in thirteen hundred cases of epidemic meningitis" (PDF). J Exp Med. 17 (5): 553–76. PMID 19867668. डीओआइ:10.1084/jem.17.5.553. पी॰एम॰सी॰ 2125091.
- ↑ अ आ Swartz MN (2004). "Bacterial meningitis—a view of the past 90 years". The New England Journal of Medicine. 351 (18): 1826–28. PMID 15509815. डीओआइ:10.1056/NEJMp048246. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Rosenberg DH, Arling PA (1944). "Penicillin in the treatment of meningitis". Journal of the American Medical Association. 125 (15): 1011–17. डीओआइ:10.1001/jama.1944.02850330009002. reproduced in Rosenberg DH, Arling PA (1984). "Penicillin in the treatment of meningitis". Journal of the American Medical Association. 251 (14): 1870–6. PMID 6366279. डीओआइ:10.1001/jama.251.14.1870. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)
