कर्कट रोग
हमारा शरीर अनेक प्रकार की सेल्स या कोशीकाओ से मिलकर बना है, ठिक उसी तरह जिस तरह अनेक प्रकार की ईंटों से मकान या इमारत बनाई जाती हैं। कोशिकाएं या सेल्स से शरीर के अंग भी बनते हैं, और यही अंग मिलकर एक स्वस्थ शरीर का निर्माण करते हैं। यह सेल्स शरीर के डी॰एन॰ए॰ के द्वारा नियंत्रित होती है, यह डी॰एन॰ए॰ एक कंप्यूटर साॅफ्टवेयर की तरह सेल्स को नियंत्रित करता है। कोशिकाएं शरीर में हमेशा विभाजित होती रेहती है, और नई कोशिकाएं बन जाती है, जेसाकी आपने पढ़ा की यह सब डी॰एन॰ए॰ के माध्यम से होता , पर कभी कभी डी॰एन॰ए॰ से गलतीया हो जाती है, और खराब सेल्स बन जाती है, और यह भी विभाजीत होती रेहती है, उनकी संख्या भी बढ़ती जाती है, और शरीर का कोई अंग ठिक तरीके से काम नहीं करता और आगे चलके कैंसर का रुप ले लेता है। हमारे शरीर के सभी अंग एक-दूसरे से जुड़े हुए होते , यही खराब कोशिका दुसरे अंग में भी प्रवेश करती है, और उसको भी काम करने में अड़चन आती है। और कैंसर पूरे शरीर में फैलता है। शुरुवात में शरीर एक ही अंग में बनने वाले खराब कोशिका यानी कैंसर कोशिकाओं पेहले स्टेज का कैंसर (primary stage cancer) और बाद में दुसरे अंग में प्रवेश कर ने पर यह सेकंडरी कैंसर (secondary cancer) या मॅटॅस्टीक कैंसर (metastatic cancer) कहते हैं।
| Cancer वर्गीकरण एवं बाह्य साधन | |
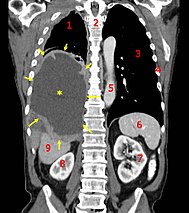 | |
|---|---|
| A coronal CT scan showing malignant cancer of the lung sac. Legend: → tumor ←, ★ central pleural effusion, 1&3 lungs, 2 spine, 4 ribs, 5 aorta, 6 spleen, 7&8 kidneys, 9 liver. | |
| डिज़ीज़-डीबी | 28843 |
| मेडलाइन प्लस | 001289 |
| एम.ईएसएच | D009369 |
अलकृ रोग (चिकित्सकीय पद: दुर्दम नववृद्धि) रोगों का एक वर्ग है जिसमें कोशिकाओं का एक समूह अनियंत्रित वृद्धि (सामान्य सीमा से अधिक विभाजन), रोग आक्रमण (आस-पास के उतकों का विनाश और उन पर आक्रमण) और कभी कभी अपररूपांतरण अथवा मेटास्टैसिस (लसिका या रक्त के माध्यम से शरीर के अन्य भागों में फ़ैल जाता है) प्रदर्शित करता है। कर्क के ये तीन दुर्दम लक्षण इसे सौम्य गाँठ (ट्यूमर या अबुर्द) से विभेदित करते हैं, जो स्वयं सीमित हैं, आक्रामक नहीं हैं या अपररूपांतरण प्रर्दशित नहीं करते हैं। अधिकांश कर्क एक गाँठ या अबुर्द (ट्यूमर) बनाते हैं, लेकिन कुछ, जैसे रक्त कर्कट (श्वेतरक्तता) गाँठ नहीं बनाता है। चिकित्सा की वह शाखा जो कर्क के अध्ययन, निदान, उपचार और रोकथाम से सम्बंधित है, ऑन्कोलॉजी या अर्बुदविज्ञान कहलाती है।
कर्कट सभी उम्र के लोगों को, यहाँ तक कि भ्रूण को भी प्रभावित कर सकता है, लेकिन अधिकांश किस्मों का जोखिम उम्र के साथ बढ़ता है।[1] कर्क में से १३% का कारण है।[2] अमेरिकन कैंसर सोसायटी के अनुसार, २००७ के दौरान पूरे विश्व में ७६ लाख लोगों की मृत्यु कर्क के कारण हुई। [3] कर्क सभी जानवरों को प्रभावित कर सकता है।
लगभग सभी अलकृ रूपांतरित कोशिकाओं के आनुवंशिक पदार्थ में असामान्यताओं के कारण होते हैं।[4] ये असामान्यताएं कार्सिनोजन या का कर्कटजन (कर्कट पैदा करने वाले कारक) के कारण हो सकती हैं जैसे तम्बाकू धूम्रपान, विकिरण, रसायन, या संक्रामक कारक. कर्कट को उत्पन्न करने वाली अन्य आनुवंशिक असामान्यताएं कभी कभी DNA कर्कट (डीएनए) प्रतिकृति में त्रुटि के कारण हो सकती हैं, या आनुवंशिक रूप से प्राप्त हो सकती हैं और इस प्रकार से जन्म से ही सभी कोशिकाओं में उपस्थित होती हैं।
कर्कट की आनुवंशिकता सामान्यतया कार्सिनोजन और पोषक के जीनोम के बीच जटिल अंतर्क्रिया से प्रभावित होती है। कर्कट रोगजनन की आनुवंशिकी के नए पहलू जैसे DNA (डीएनए) मेथिलिकरण और माइक्रो RNA (आरएनए), का महत्त्व तेजी से बढ़ रहा है।
कर्कट में पाई जाने वाली आनुवंशिक असामान्यताएं आमतौर पर जीन के दो सामान्य वर्गों को प्रभावित करती हैं। कर्कट को बढ़ावा देने वाले अर्बुदजीन प्रारूपिक रूप से कर्कट की कोशिकाओं में सक्रिय होते हैं, उन कोशिकाओं को नए गुण दे देते हैं, जैसे सामान्य से अधिक वृद्धि और विभाजन, क्रमादेशित कोशिका मृत्यु से सुरक्षा, सामान्य उतक सीमाओं का अभाव और विविध ऊतक वातावरण में स्थापित होने की क्षमता.
इसके बाद गाँठ का शमन करने वाले जीन कर्कट की कोशिकाओं में निष्क्रिय हो जाते हैं, जिसके परिणामस्वरूप उन कोशिकाओं की सामान्य क्रियाओं में कमी आ जाती है, जैसे सही DNA (डीएनए) प्रतिकृति, कोशिका चक्र पर नियंत्रण, ऊतकों के भीतर अभिविन्यास और आसंजन और प्रतिरक्षा तंत्र की सुरक्षात्मक कोशिकाओं के साथ पारस्परिक क्रिया.
आम तौर पर इसके निदान के लिए एक रोग निदान विज्ञानी को एक उतक बायोप्सी नमूने का ऊतक वैज्ञानिक परीक्षण करना पड़ता है, यद्यपि दुर्दमता के प्रारंभिक संकेत विकिरण लेखी चित्रण असमान्यता के लक्षण हो सकते हैं।
अधिकांश कर्कट रोगों का इलाज किया जा सकता है, कुछ को ठीक भी किया जा सकता है, यह कर्कट के विशेष प्रकार, स्थिति और अवस्था पर निर्भर करता है। एक बार निदान हो जाने पर, कर्कट का उपचार शल्य चिकित्सा, रसायन चिकित्सा और विकिरण चिकित्सा के संयोजन के द्वारा किया जा सकता है। अनुसंधान के विकास के साथ, कर्कट की विभिन्न किस्मों के लिए उपचार और अधिक विशिष्ट हो रहे हैं।लक्षित थेरेपी दवाओं के विकास में महत्वपूर्ण प्रगति हुई है जो विशिष्ट गाँठ में जांच योग्य आणविक असामान्यताओं पर विशेष रूप से कार्य करती हैं और सामान्य कोशिकाओं में क्षति को कम करती हैं। कर्कट के रोगियों का पूर्व निदान कर्कट के प्रकार से बहुत अधिक प्रभावित होता है, साथ ही रोग की अवस्था और सीमा का भी इस पर प्रभाव पड़ता है। इसके अलावा, औतक वैज्ञानिक (हिस्टोलोजिक) श्रेणीकरण और विशिष्ट आणविक चिह्नक की उपस्थिति भी रोग के पूर्व निदान में तथा व्यक्तिगत उपचार के निर्धारण में सहायक हो सकती है।
शब्दकोश[संपादित करें]
निम्नलिखित निकट सम्बंधित शब्दों का उपयोग असामान्य वृद्धि को नामित करने के लिए किया जा सकता है:
- गाँठ या अबुर्द: मूलतः, इसका अर्थ है कोई भी असामान्य सूजन, मांस का पिंड या टुकडॉ॰
वर्तमान अंग्रेज़ी में, यद्यपि, शब्द ट्यूमर, नियोप्लास्म, विशेष रूप से ठोस नियोप्लास्म का पर्याय बन गया है। ध्यान दें कि कुछ नियोप्लास्म, जैसे रक्त कर्कट (श्वेतरक्तता), गाँठ (ट्यूमर) का निर्माण नहीं करते हैं।
- नियोप्लास्म : एक वैज्ञानिक शब्द जो आनुवंशिक रूप से परिवर्तित कोशिकाओं के असामान्य प्रचुरोदभवन का वर्णन करता है। नियोप्लास्म दुर्दम या सौम्य हो सकता है।
- दुर्दम नियोप्लास्म या दुर्दम गाँठ : कर्कट का पर्याय है।
- सौम्य नियोप्लास्म या सौम्य गाँठ : एक गाँठ (ठोस नियोप्लास्म) जिसकी वृद्धि खुद ही रुक जाती है, यह अन्य उतकों पर आक्रमण नहीं करती है और मेटास्टेसिस प्रर्दशित नहीं करती है।
- आक्रामक या संक्रामक गाँठ का कर्कट का एक अन्य पर्याय है। इस नाम का उपयोग आस-पास के उतकों के संक्रमण के लिए किया जाता है।
- पूर्व-दुर्दमता, पूर्व कर्कट या असंक्रामक गाँठ: एक नियाप्लास्म जो संक्रामक नहीं है लेकिन उपचार नहीं किए जाने पर कर्कटका रूप ले सकती हैं (संक्रामक हो सकती हैं).ये घाव कर्कटकी क्षमता के बढ़ने के आरोही क्रम में हैं, ये हैं एटाइपिया, डिसप्लाजिया और कार्सिनोमा स्वस्थानी .
एक कर्कटका वर्णन करने के लिए निम्न शब्दों का उपयोग किया जा सकता है।
- स्क्रीनिंग : स्वस्थ व्यक्तियों में किया जाने वाला एक परीक्षण जो गाँठ के उत्पन्न होने से पहले ही उनकी जांच के लिए किया जाता है। एक मेमोग्राम एक स्क्रीनिंग परीक्षण है।
- निदान : एक गांठ की कर्कट प्रकृति की पुष्टि.इसमें सामान्यतया एक बायोप्सी या शल्य चिकित्सा के द्वारा गाँठ को हटाया जाता है, ऐसा एक रोगविज्ञानी के परीक्षण के बाद किया जाता है।
- शल्य विच्छेदन : एक ट्यूमर को एक शल्य चिकित्सक के द्वारा हटाया जाना.
- शल्य हाशिए : एक शल्य चिकित्सक के द्वारा हटाये गए उतक के किनारों का एक रोगविज्ञानी के द्वारा मूल्यांकन जिससे यह निर्धारित किया जाता है कि गाँठ को पूरी तरह से हटा दिया गया है ("नकारात्मक हाशिए") या गाँठ बच गई है ("सकारात्मक हाशिए").
- श्रेणी : एक रोगविज्ञानी के द्वारा स्थापित की गयी संख्या (सामान्यतया 3 के पैमाने पर) जो आस पास के सौम्य उतक की गाँठ के साथ समानता के अंश का वर्णन करने के लिए दी जाती है।
- अवस्था : एक संख्या (सामान्यतया 4 के पैमाने पर) जो एक कर्कट विज्ञानी गाँठ के द्वारा शरीर पर आक्रमण के अंश का वर्णन करने के लिए देता है।
- पुनरावृत्ति : नई गाँठ जो शल्य चिकित्सा के बाद पहले वाली गाँठ के स्थान पर ही उत्पन्न होती है।
- मेटास्टेसिस : नयी गाँठ जो कि मूल गाँठ से दूर उत्पन्न होती है।
- रूपांतरण : अवधारणा जिसके अनुसार समय के साथ एक कम श्रेणी की गाँठ, एक उच्च श्रेणी की गाँठ में रूपांतरित हो जाती है। उदाहरण: रिक्टर का रूपांतरण.
- कीमोथैरेपी : दवाओं से इलाज.
- विकिरण चिकित्सा : विकिरण से उपचार.
- सहयोगी चिकित्सा : उपचार, या तो कीमोथेरपी या विकिरण चिकित्सा, जो शल्य चिकित्सा के बाद शेष कर्कट की कोशिकाओं को मारने के लिए दिया जाता है।
- पूर्वानुमान : थेरेपी के बाद उपचार की संभावनाइसे सामान्यतया निदान के बाद पाँच साल जीवित रहने की सम्भावना के रूप में व्यक्त किया जाता है। वैकल्पिक रूप से, इसे वर्षों की संख्या के रूप में व्यक्त किया जा सकता है जब 50% रोगी अभी भी जीवित हों.दोनों ही संख्याएँ सैंकडों समान रोगियों से संचित किये गए आंकडों से उत्पन्न हुई व्युत्पन्न हुई हैं जो कपलन-मेयर वक्र बनाती हैं।
सबसे आम कैंसर के प्रकार[संपादित करें]
कैंसर के मुख्य रूप से दो प्रकार होते हैं ।
1) ब्लड कैंसर ( blood cancer ) :- ल्युकेमिया एक प्रकार का ब्लड कैंसर होता है , इसमें बोर्नमैरो में सफेद कोशिकाएं बेहद जल्दी बढ़ती है, इसमें इसकी जगह , कैंसर कोशिकाएं बढ़ती है और अच्छी कोशिकाओं बढ़ने की जगह नहीं मिलती ।
2) साॅलिड ट्युमर ( solid tumors ) :- इस अवस्था में कैंसर कोशिकाएं शरीर अंग में गुच्छा बनाकर रेहती, जिसे ट्युमर केहते है, यह जिस अंग में रेस्तरां है उस अंग को खराब करती है , शरीर के किसी भी हिस्से में यह बढ़ सकता है, इसके भी दो प्रकार होते हैं,
A) विनाईन ट्युमर ( ) :- यह ट्युमर जान के लिए इतना ख़तरनाक नहीं होता क्योंकि यह बहोत धीरे धीरे बढ़ता है ,
B) मेलगेनीस ट्यमर ( ) :- यह ट्युमर बहोत तेजी से बढ़ता है, और जान के लिए ख़तरनाक होता है, इसलिए इसका तुरंत उपचार करना चाहिए ।
अन्य प्रकार :-
3) साक्रोमा ( sacorma ) :- यह कैंसर हड्डियों , मांसपेशियो , रक्त वाहिकाओं का एक कैंसर हैं ।
4) कार्सीनोमा ( carcinoma ) :- कार्सीनोमा कैंसर त्वचा और ऊतकों से शुरू होता है, और बाद में अन्य अंगों को प्रभावित करता है।
4) लिंफोमा ( lymphoma ) :- यह एक इम्युनिटी का कैंसर होता है। इसके साथ मायलोमा भी इम्युनिटी का ही कैंसर होता है।
कैंसर के 100 से अधिक प्रकार हैं। कैंसर के प्रकार का नाम ,आमतौर पर उन अंगों या ऊतकों के लिए नाम दिया जाता है ,जहां कैंसर शुरू होता हैं, लेकिन उन्हें उन कोशिकाओं के प्रकार के नाम से भी जाना जाता है जिनसे वो बनते है। [5]।
सॉफ्ट टिश्यू सारकोमा
ब्लैडर कैंसर
स्तन कैंसर
कोलोरेक्टल कैंसर
किडनी कैंसर (रेनल सेल)
ल्यूकेमिया
यकृत कैंसर
फेफड़ों का कैंसर
लिम्फोमा
अग्नाशय का कैंसर
प्रोस्टेट कैंसर
त्वचा कैंसर
गलग्रंथि का कैंसर
गर्भाशय का कैंसर
वर्गीकरण[संपादित करें]

कर्कट को कोशिका के प्रकार के आधार पर वर्गीकृत किया जाता है जो गाँठ से समानता रखती है, इसीलिए, उतक को गाँठ से उत्पन्न माना जा सकता है। ये क्रमशः उतक विज्ञान और स्थान हैं। सामान्य श्रेणी के उदाहरणों में शामिल हैं:
- कार्सिनोमा : उपकला कोशिकाओं से व्युत्पन्न दुर्दम गाँठ.यह समूह सबसे सामान्य कैंसरों को अभिव्यक्त करता है, जिसमें स्तन, प्रोस्टेट, फेफड़े और बड़ी आंत के कर्कट के सामान्य रूप शामिल हैं।
- सार्कोमा : संयोजी ऊतक, या मध्योतक कोशिकाओं से व्युत्पन्न दुर्दम गाँठ.
- लिंफोमा और रक्त कर्कट (श्वेतरक्तता) : दुर्दमता हिमेटोपोयटिक (रक्त-बनाने वाली) कोशिकाओं से उत्पन्न होती है।
- जनन कोशिका गाँठ : टोटीपोटेंट कोशिका से उत्पन्न गाँठ. वयस्कों में अक्सर शुक्र ग्रंथि और अंडाशय में पाया जाता है; भ्रूण, बच्चों और छोटे बच्चों में अधिकांशतया शरीर की मध्य रेखा पर, विशेष रूप से पुच्छ अस्थि के शीर्ष पर पाया जाता है; घोड़ों में अक्सर पोल (खोपड़ी के आधार) पर पाया जाता है।
- ब्लास्टिक गाँठ या ब्लास्टोमा: एक गाँठ (आमतौर पर दुर्दम) जो एक अपरिपक्व या भ्रूणीय उतक के समान होती है।
इन में से अधिकंश गांठें बच्चों में आम हैं।
दुर्दम गांठों (कर्कट) के नाम में आम तौर पर -कार्सिनोमा, -सार्कोमा या -ब्लास्टोमा जैसे शब्दों का उपयोग प्रत्यय के रूप में किया जाता है, इसके साथ मूल शब्द के रूप में उत्पत्ति के अंग के लिए लैटिन या ग्रीक शब्द का प्रयोग किया जाता है। उदाहरण के लिए, यकृत का कर्कट हिपेटोकार्सिनोमा कहलाता है; वसा कोशिकाओं का कर्कट लिपोसार्कोमा कहलाता है। आम कैंसरों के लिए, अंग के अंग्रेजी नाम का प्रयोग किया जाता है। उदाहरण के लिए स्तन कैंसर का सबसे सामान्य प्रकार स्तन का वाहिनी परक कार्सिनोमा या मेमेरी डकटल कार्सिनोमा कहलाता है।
यहाँ पर विशेषण डकटल का उपयोग सूक्ष्मदर्शी में दिखायी देने वाले उस कर्कट के सन्दर्भ में किया जाता है, जो सामान्य स्तन की वाहिनियों से समानता रखती हैं।
वाहिनी शब्द का उपयोग, सूक्ष्मदर्शी में दिखाई देने वाली स्तन वाहिनियों के कर्कट के लिए किया गया है।
सौम्य गाँठ (जो कर्कट नहीं हैं) उनके नाम में -ओमा प्रत्यय का प्रयोग किया जाता है, जिसमें मूल शब्द अंग का नाम होता है। उदाहरण के लिए, गर्भाशय की चिकनी पेशी की एक सौम्य गाँठ लियोमायोमा कहलाती है। (प्रायः पायी जाने वाली इस गाँठ का सामान्य नाम है फाईब्रोइड अर्थात रेशेदार).दुर्भाग्य से, कुछ तरह के कैंसरों के लिए भी -ओमा प्रत्यय का प्रयोग किया जाता है, जैसे मेलेनोमा और सेमिनोमा.
चिन्ह और लक्षण[संपादित करें]
[[चित्र:Symptoms of cancer
1) वजन ( Weight ) :- अचानक से वजन कम या ज्यादा होना कैंसर का एक लक्षण होता है
2) थकान (tiredness ) :- अगर दिनभर काम करते समय में जरुरत से थकान या कमजोरी महसूस होती हो तो यह भी कैंसर का लक्षण होता है।
3) त्वचा बदलाव ( skin changes ) :- त्वचा के किसी भी हिस्से में बार बार नील पड़ जाती हो या उसके नीचे गाठ मेहसूस हो तो यह भी कैंसर का लक्षण होता है।
4) खांसी ( cuff ) :- लंबे समय से खांसी या सांस लेने में कठिनाइ हो रही हो तो यह भी कैंसर का लक्षण होता है।
5) पाचन रोग ( digestive disease ) :- पाचन रोग भी इसका एक लक्षण होता है, पाचन समस्या में बार बार दस्त , कब्ज़ होते हैं।
6) भुक कम लगना ( loss of appetite ) :- कैंसर के लक्षणों में भुक भी कम होती या खाने की इच्छा ही नहीं होती।
7) बार बार बुखार आना ( frequent fever ) :- अगर बार बार बुखार आने की समस्या होती हो तो यह भी कैंसर का लक्षण होता है।
8) मांसपेशियों में दर्द ( muscle pain ) :- अगर बार बार मांसपेशियों में खिंचाव और दर्द मेहसूस हो, तो यह कैंसर के शुरूवाती लक्षण होते हैं, और साथ ही रात को ज्यादा पसीना आना भी इसमें शामिल हैं ।
9) संक्रमण होना ( getting infected ) :- बार बार संक्रमण होना भी एक कैंसर का लक्षण होता है।
metastasis.svg|thumb|right|विक्षेप कर्कट के लक्षण जो अबुर्द की स्थिति पर निर्भर करते हैं।]]
मोटे तौर पर, कर्कट के लक्षणों को तीन समूहों में विभाजित किया जा सकता है:
- स्थानीय लक्षण : असामान्य गाँठ या सूजन (अबुर्द), रक्तस्राव (खून बहना), पीड़ा और / या व्रनोदभवन (अल्सर का निर्माण). आसपास के ऊतकों में संपीड़न की वजह से पीलिया जैसे लक्षण पैदा हो सकते हैं (आंखों और त्वचा का पीलापन).
- मेटास्टेसिस (फैलना) के लक्षण : लसिका पर्वों का आकार में बढ़ना, खाँसी और हिमोपटायसिस, हिपेटोमिगेली (यकृत का आकार में बढ़ना), अस्थि पीडा (हड्डी में दर्द), प्रभावित अस्थियों का टूटना और तंत्रीकीय लक्षण.
यद्यपि विकसित हो चुके कर्कट में दर्द हो सकता है, अक्सर यह प्रारंभिक लक्षण नहीं होता है।
- प्रणालीगत लक्षण : वजन घटना, भूख में कमी, थकान और कैचेक्सिया (व्यर्थ होना), अत्यधिक पसीना आना (रात को पसीना आना), रक्ताल्पता और विशिष्ट पेरानियोप्लास्टिक घटना, अर्थात विशेष परिस्थितियां जो सक्रिय कर्कट के कारण होती हैं जैसे घनास्त्रता (थ्रोम्बोसिस) या हार्मोन परिवर्तन.
उपरोक्त सूची में से प्रत्येक लक्षण कई प्रकार की स्थितियों के कारण हो सकता है (जिसकी एक सूची विभेदक निदान के रूप में दी गई है).कर्कट प्रत्येक मद के लिए एक आम या असामान्य कारण हो सकता है।
कारण[संपादित करें]
कर्क भिन्न रोगों का एक वर्ग है जो अपने कारणों और जैव-विज्ञान में व्यापक भिन्नता रखते हैं। कोई भी जीव, यहां तक कि पौधों, में भी कर्कट कैंसर हो सकता है। लगभग सभी कर्कट कैंसर धीरे धीरे बढ़ते हैं, कर्कट और कैंसर की कोशिकाओं और इसकी पुत्री कोशिकाओं में त्रुटि उत्पन्न हो जाती है (सामान्य प्रकार की त्रुटियों के लिए क्रियाविधि भाग देखें).
कोई भी चीज जो प्रतिकृति करती है (हमारी कोशिकाएं) संभवतया त्रुटियों से पीड़ित हो सकती हैं (उत्परिवर्तन). यदि त्रुटि सुधार और रोकथाम ठीक प्रकार से न किया जाये त्रुटियां बनी रहेंगी और पुत्री कोशिकाओं को भी स्थानांतरित हो सकती हैं।
आम तौर पर, शरीर कई विधियों के माध्यम से कर्कट के खिलाफ बचने की कोशिश करता है, जैसे: एपोप्टोसिस, सहायक अणु (कुछ DNA पोलीमरेज), सम्भवतः जीर्णता आदि। हालांकि ये त्रुटि सुधार विधियां छोटे मायनों में अक्सर असफल हो जाती हैं, विशेष रूप से ऐसे वातावरण में जहां त्रुटियों के उत्पन्न होने और बढ़ने की संभावनाएं अधिक होती हैं।
उदाहरण के लिए, ऐसे वातारण में विघटनकारी तत्व शामिल हो सकते हैं जो कार्सिनोजन (कर्कट पैदा करने वाले कारक) कहलाते हैं। या आवधिक चोट (भौतिक, ऊष्मा आदि) हो सकती है, या वातावरण जिसमें कोशिकाएं अपने अस्तित्व के लिए विकसित नहीं हुई हों, जैसे हाइपोक्सिया[6] (देखें उपभाग).
इस प्रकार से कर्कट एक प्रगतिशील रोग है और ये प्रगतिशील त्रुटियां धीरे धीरे कोशिका में संचित होती रहती हैं जब तक जंतु में उपस्थित कोशिका अपने कार्यों के विपरीत कार्य नहीं करने लगती.
वे त्रुटियां जो कर्कट का कारण होती हैं, अक्सर स्व-प्रवर्धनशील होती हैं, अंततः एक घातीय दर (धन की तरह) पर बढ़ती हैं।
उदाहरण के लिए:
- एक कोशिका त्रुटि सुधार मशीनरी में एक उत्परिवर्तन, उस कोशिका और उसकी संतति में त्रुटियों के अधिक तेजी से संचित होने का कारण बन सकता है।
- कोशिका की संकेतन (अन्तः स्रावी) मशीनरी में एक उत्परिवर्तन, आस पास की कोशिकाओं में त्रुटि उत्पन्न करने वाले संकेत भेज सकता है।
- एक उत्परिवर्तन के कारण कोशिकाएं नियोप्लास्टिक बन सकती हैं, जिसके कारण वे स्थानांतरित होकर अधिक स्वस्थ कोशिकाओं के कार्य को बाधित कर सकती हैं।
- एक उत्परिवर्तन के कारण कोशिका अमर बन सकती है (देखें टेलोमेयर्स), जिसके कारण वे हमेशा के लिए स्वस्थ कोशिकाओं को बाधित करती हैं।
इस प्रकार से कर्कट अक्सर कुछ त्रुटियों के कारण एक श्रृंखला अभिक्रिया के रूप में विस्फोटित होता है, ये त्रुटियां संयुक्त होकर अधिक गंभीर त्रुटियां बनाती हैं।
ऐसी त्रुटियां जो अधिक त्रुटियां उत्पन्न करती हैं, वे प्रभावी रूप से कर्कट का मूल कारण हैं और साथ ही, ये इस बात का कारण भी हैं कि कर्कट का उपचार बहुत मुश्किल है: चाहे कर्कट की 10,000,000,000 कोशिकाओं में से सब को मार देने के बाद, उनमें से (और त्रुटि प्रवण पूर्व कर्कट कोशिकाएं) केवल 10 कोशिकाएं अपनी प्रतिकृति कर सकती हैं या त्रुटि उत्पन्न करने वाले संकेतों को अन्य कोशिकाओं को भेज सकती हैं तो प्रक्रिया फिर से शुरू हो जाती है। यह विद्रोह सदृश परिदृश्य अवांछनीय योग्यतम की उत्तरजीविता है, जहां विकासवादी बल खुद शरीर के डिजाइन और व्यवस्था को लागू करने के विरुद्ध कार्य करते हैं
वास्तव में, एक बार जब कर्कट विकसित होना शुरू हो जाता है, यही बल निरन्तर अधिक आक्रामक अवस्थाओं की ओर कर्कट की प्रगति में सहायक होता है, ओर यह क्लोनल विकास कहलाता है।[7]
कर्कट के कारणों के बारे में अनुसंधान अक्सर निम्नलिखित श्रेणियों में आते हैं:
- कारक (उदाहरण वायरस) ओर घटनाएं (उदाहरण उत्परिवर्तन) जो कोशिकाओं में आनुवंशिक परिवर्तनों के द्वारा कर्कट को जन्म देते हैं।
- आनुवंशिक क्षति की यथार्थ प्रकृति और जीन जो इसके द्वारा प्रभावित होते हैं।
- कोशिका के जीव विज्ञान पर उन आनुवंशिक परिवर्तनों के परिणाम, एक कर्कट कोशिका के लाक्षणिक गुणों को उत्पन्न करने में और साथ ही अतिरिक्त आनुवंशिक घटनाओं को बढ़ावा देने में जो आगे कर्कट के विकास में सहायक हैं।
उत्परिवर्तन: रासायनिक कर्सिनोजन (कर्कट पैदा करने वाले कारक)[संपादित करें]
कर्कट रोग जनन का कारण है DNA (डीएनए) उत्परिवर्तन जो कोशिका वृद्धि और मेटास्टेसिस को प्रभावित करता है।
वे पदार्थ जो DNA (डीएनए) उत्परिवर्तन का कारण हैं उत्परिवर्तजन कहलाते हैं और वे उत्परिवर्तजन जो कर्कट का कारण हैं, कार्सिनोजन कहलाते हैं। कई विशेष प्रकार के पदार्थ विशिष्ट प्रकार के विक्षेपसे जुड़े हुए हैं।तम्बाकू धूम्रपान कर्कट के कई रूपों से सम्बंधित है,[8] और 90% फेफड़ों के कैंसर का कारण है।[9] लम्बे समय तक एस्बेस्टस फाइबर के संपर्क में रहने से मिजोथेलिओमा हो सकता है।[10]
अनेक उत्परिवर्तजन कार्सिनोजन भी हैं, लेकिन कुछ कार्सिनोजन उत्परिवर्तजन नहीं हैं।एल्कोहल एक रासायनिक कार्सिनोजन का उदाहरण है जो उत्परिवर्तजन नहीं है।[11] इस प्रकार के रसायन कोशिका विभाजन की दर को उत्प्रेरित करके कैंसर को बढ़ावा देते हैं। प्रतिकृति की तेज दर एंजाइमों की मरम्मत के लिए कम समय देती है जिससे DNA (डीएनए) प्रतिकृति के दौरान क्षतिग्रस्त DNA (डीएनए) की मरम्मत के लिए पर्याप्त समय नहीं मिल पता है, जिसके कारण एक उत्परिवर्तन की संभावना बढ़ जाती है।

कई दशकों के अनुसंधान तम्बाकू के उपयोग और फुफ्फुस, स्वर यंत्र, सिर, गर्दन, आमाशय, मूत्राशय, वृक्क, ग्रसनी और अग्नाशय के कैंसर के बीच सम्बन्ध को प्रर्दशित करते हैं।[12] तम्बाकू धूम्रपान में नाइट्रोसेमाइन और बहुचक्रीय हाइड्रोकार्बन सहित पचास ज्ञात कार्सिनोजन पाए जाते हैं[13] तम्बाकू विकसित दुनिया में तीन में से एक कैंसर मृत्यु के लिए उत्तरदायी है,[8] और दुनिया भर में लगभग पांच में से एक मृत्यु के लिए। [13] दरअसल, संयुक्त राज्य अमेरिका में फुफ्फुस की कैंसर मृत्यु की दर ने धुम्रपान के प्रतिरूप को प्रतिबिंबित किया है, जिसके अनुसार धुम्रपान में वृद्धि के साथ फुफ्फुस कैंसर मृत्यु दर में वृद्धि होती है और अधिक हाल ही में दर्शाया गया कि धुम्रपान में कमी से पुरुषों में फुफ्फुस कैंसर मृत्यु दर में भी कमी होती है।
हालांकि, दुनिया भर में अभी भी धुम्रपान करने वालों की संख्या बढ़ रही है, कुछ संगठनों के द्वारा इसके कारण उत्पन्न वाली स्थिति को तम्बाकू महामारी के रूप में वर्णित किया गया है।[14]
उत्परिवर्तन: आयनीकरण करने वाले विकिरण[संपादित करें]
आयनीकरण करने वाले विकिरण के स्रोत जैसे रेडोन गैस, कैंसर पैदा कर सकते हैं। सूर्य के पराबैंगनी विकिरण के लंबे समय तक संपर्क में रहने से मेलेनोमा और अन्य त्वचा दुर्दमताएं हो सकती हैं।[15]
मोबाइल फोन और अन्य स्रोतों से निकलने वाले गैर-आयनीकरण आवृति विकिरण भी कैंसर का कारण माने गए हैं, लेकिन ऐसे सम्बन्ध के बहुत कम प्रमाण मिले हैं।[16] फिर भी कुछ विशेषज्ञ एहतियाती सिद्धांत के आधार पर लम्बे समय तक ऎसी चीजों के संपर्क में रहने से बचने की सलाह देते हैं।[17]
वायरस या जीवाणु का संक्रमण[संपादित करें]
कुछ कर्कट रोगज़नक़ के संक्रमण के कारण हो सकते हैं।[18] कई कैंसर एक वायरस के संक्रमण के कारण होते हैं; यह विशेष रूप से जंतुओं जैसे पक्षियों में देखा जाता है, लेकिन मनुष्यों में भी ऐसा होता है, पूरी दुनिया में 15% मानव कैंसर के लिए वायरस ही जिम्मेदार हैं। मानव के कैंसर से सम्बंधित मुख्य वायरस हैं मानव पेपिलोमा वायरस, हैपेटाइटिस बी और हेपेटाइटिस सी वायरस, एपस्टीन-बार वायरस और मानव टी -लिम्फोट्रोपिक वायरस.
प्रायोगिक और महामारी आंकडे वायरस की एक कारक भूमिका का संकेत देते हैं और वे मानव में कैंसर के विकास के लिए दूसरे सबसे महत्वपूर्ण जोखिम कारक के रूप में सामने आये हैं, जबकि पहला कारक तम्बाकू का उपयोग है।[19] वायरस-प्रेरित गांठों को दो प्रकारों में विभाजित किया जा सकता है, तीव्रता से रूपांतरित होने वाले और धीरे धीरे रूपांतरित होने वाले .
तीव्रता से रूपांतरित होने वाले वायरसों में वायरस एक अतिसक्रिय ओंकोजीन को संवाहित करता है जिसे वायरल-ओंकोजीन (v-onc) कहा जाता है और संक्रमित कोशिका v-onc की अभिव्यक्ति के साथ तुंरत ही रूपांतरित हो जाती है। इसके विपरीत, धीरे धीरे रूपांतरित होने वाले वायरस में, वायरस जीनोम, पोषी के जीनोम में एक प्रोटो-ओंकोजीन के पास प्रविष्ट होता है।
अब वायरल प्रवर्तक या अन्य प्रतिलेखन विनियमन तत्व उस प्रोटो-ओंकोजीन की अति-अभिव्यक्ति का कारण बनते हैं। इसमें अनियंत्रित कोशिका विभाजन शामिल है। क्योंकि प्रविष्टि का स्थान प्रोटो-ओंकोजीन के लिए विशिष्ट नहीं होता है और किसी भी प्रोटो-ओंकोजीन के पास प्रविष्टि की सम्भावना कम होती है, धीमी गति से रूपांतरित होने वाले वायरस, तीव्रता से रूपांतरित होने वाले वायरस की तुलना में, संक्रमण के अधिक लम्बे समय के बाद गाँठ पैदा करते हैं।
हैपेटाइटिस बी और हेपेटाइटिस सी सहित हेपेटाइटिस वायरस, एक दीर्घकालिक (क्रोनिक) वायरल संक्रमण को प्रेरित कर सकता है, जो प्रतिवर्ष हैपेटाइटिस बी के 0.47% रोगियों में (विशेष रूप से एशिया में, उत्तरी अमेरिका में ऐसा कम देखा गया है) और प्रति वर्ष हेपेटाइटिस सी के 1.4% रोगियों में यकृत कैंसर का कारण है। लीवर सिरोसिस, चाहे क्रोनिक वायरल हैपेटाइटिस संक्रमण के कारण हो या शराब पीने के कारण, यह यकृत कैंसर के विकास से सम्बंधित होता है और सिरोसिस और वायरल हैपेटाइटिस का संयोजन यकृत कैंसर विकास के उच्चतम जोखिम का कारण है। दुनिया भर में वायरल हैपेटाइटिस के संचरण और रोग के भारी बोझ के कारण, यकृत कैंसर सबसे आम और सबसे अधिक घातक कैंसरों में से एक है।
कैंसर अनुसंधान में आधुनिकीकरण ने कैंसर को रोकने के लिए एक वेक्सीन को डिजाइन किया है। 2006 में, यू. एस. फूड एंड ड्रग एडमिनिस्ट्रेशन ने एक मानव पेपिलोमा वायरस वेक्सीन को स्वीकृति दी जिसे गार्दासिल कहा जाता है। वेक्सीन चार HPV (एचपीवी) प्रकारों से सुरक्षा करती है, जो 70% गर्भाशय ग्रीवा के कैंसर और 90% जननांग मस्सों का कारण हैं। मार्च 2007 में, यू. एस. सेंटर्स फॉर डिजीज कंट्रोल एंड प्रिवेंशन (CDC) प्रतिरक्षा प्रक्रियाओं पर सलाहकार समिटी (ACIP) ने अधिकारिक रूप से सलाह दी की 11-12 आयु वर्ग की लड़कियों को वेक्सीन दी जानी चाहिए और इंगित किया कि 9 साल की छोटी लड़कियों से लेकर 26 साल की आयु तक की महिलाएं इस प्रतिरक्षा के लिए पात्र हैं अर्थात उन्हें यह टीका लगाया जा सकता है।
वायरस के अलावा, शोधकर्ताओं ने जीवाणु और कुछ विशेष प्रकार के कर्कट के बीच सम्बन्ध पाया है। सबसे प्रमुख उदाहरण है आमाशय के कर्कट और आमाशय की दीवार के हेलिकोबेक्टर पायलोरी के द्वारा जीर्ण संक्रमण के बीच सम्बन्ध.[20][21] हालांकि बहुत कम मामलों में हेलिकोबेक्टर का संक्रमण जीर्णमें विकसित होता है, चूंकि यह रोगजनक बहुत आम है, यह संभवतया इस प्रकार के अधिकांश कर्कटों के लिए उत्तरदायी है।[22] कोरोनावायरस रोग 2019 को भी कैंसर से जुड़े होने की परिकल्पना की गई है [23]
हार्मोनल असंतुलन[संपादित करें]
इसी प्रकार से कुछ होरमोन गैर-उत्परिवर्तजनिक कर्सिनोजन्स की तरह व्यवहार करते हैं, वे अतिरिक्त कोशिका वृद्धि को उत्तेजित कर सकते हैं। एक अच्छा उदाहरण है-अन्तर्गर्भाशयकला के कर्कट को विकसित करने में हाइपर एस्ट्रोजेनिक (एस्ट्रोजन होरमोन की मात्रा का बढ़ना) अवस्थाओं की भूमिका.
प्रतिरक्षा तंत्र की क्रिया प्रणाली में खराबी[संपादित करें]
HIV (एचआईवी) कई प्रकार की दुर्दमताओं से सम्बंधित है जिसमें शामिल है कापोसी सार्कोमा, गैर-होजकिन्स लिम्फोमा और HPV (एचपीवी)-सम्बंधित दुर्दमताएं जैसे गुदा कैंसर और गर्भाशय ग्रीवा का कर्कट . AIDS (एड्स)- को परिभाषित करने वाली बीमारियों में लम्बे समय से ये निदान शामिल हैं। HIV (एचआईवी) रोगियों में दुर्दमता की बढ़ती हुई घटनाएं कर्कट की एक संभव इटियोलोजी के रूप में प्रतिरक्षा निगरानी के टूटने की ओर इशारा करती हैं।[24] अन्य विशिष्ट प्रतिरक्षा की कमी की अवस्थाएं (उदाहरण आम भिन्न प्रतिरक्षा क्षति ओर IgA की कमी) भी दुर्दमता के जोखिम के बढ़ने से सम्बंधित हैं।[25]
आनुवंशिकता[संपादित करें]
कैंसर के अधिकतर रूप विकीर्ण (स्पोरेडिक) होते हैं, अर्थात उनका कोई आनुवंशिक कारण नहीं होता है।
हालांकि, ऐसे कई सिंड्रोम हैं जिनमें कैंसर के लिए अनुवांशिक रूप से प्राप्त पूर्व प्रवृति या विशेष सुग्राह्यता होती है, ऐसा अक्सर एक जीन में दोष के कारण होता है जो गाँठ के निर्माण के विरुद्ध रक्षा करता है। प्रसिद्ध उदाहरण हैं:
- BRCA1 और BRCA2 जीनों में निश्चित आनुवंशिक उत्परिवर्तन स्तन कैंसर और डिम्बग्रंथि के कैंसर के जोखिम को बढाते हैं।
- एकाधिक अन्तः स्रावी नियोप्लाजिया में भिन्न अन्तः स्रावी अंगों की गांठें (MEN प्रकार 1, 2a, 2b)
- p53 के उत्परिवर्तनों के कारण ली-फ्रामेनी सिंड्रोम (विभिन्न ट्यूमर जैसे ओस्टियो सार्कोमा, स्तन कैंसर, कोमल ऊतक सार्कोमा, मस्तिष्क का ट्यूमर).
- टरकोट सिंड्रोम (मस्तिष्क का ट्यूम और वृहद् आंत्रीय पोली पोसिस)
- फेमिलियल एडिनोमेटस पोलीपोसिस APC जीन में एक वंशागत उत्परिवर्तन जो बृहदान्त्र कार्सिनोमा की शुरुआत का कारण है।
- वंशानुगत नॉन-पोलिपोसिस बड़ी आंत-मलाशय का कैंसर (HNPCC, लिंच सिंड्रोम के रूप में भी जाना जाता है) बृहदान्त्र पोलिप्स की प्रमुखता के बिना बड़ी आंत के कैंसर, गर्भाशय के कर्कट, आमाशय के कैंसर और डिम्बग्रंथि के कर्कट, के परिचित मामले शामिल हो सकते हैं।
- दृष्टि पटल का प्रसू - अर्बुद, जब छोटे बच्चों में होता है, तो यह दृष्टि पटल का प्रसू - अर्बुद जीन में एक वंशानुगत उत्परिवर्तन के कारण होता है।
- डाउन सिंड्रोम के रोगी, जिनमें एक अतिरिक्त गुणसूत्र 21 होता है, उनमें श्वेतरक्तता और शुक्र ग्रंथि कर्कट के मामले देखे गए हैं, यद्यपि इस कारण को ठीक प्रकार से समझा नहीं गया है।
अन्य कारण[संपादित करें]
गर्भधारण के साथ और केवल एक सीमांत रूप में कुछ अंग दाताओं के साथ इस रोग का संचरण कभी कभी हो जाता है, अन्यथा कैंसर सामन्यतया एक संक्रामक रोग नहीं है। इसका मुख्य कारण है प्रमुख उतक अनुरूपता जटिल असंगति या बेजोड़ता के कारण ऊतक ग्राफ्ट अस्वीकृति.[26] मानव और अन्य कशेरुकियों में, प्रतिरक्षी तंत्र "स्व" और "गैर-स्व" कोशिकाओं के बीच विभेदन करने के लिए MHC प्रतिजनों का उपयोग करता है, क्योंकि ये प्रतिजन प्रत्येक व्यक्ति में अलग होते हैं।
जब गैर स्व प्रतिजनों का सामना होता है, तो प्रतिरक्षा तंत्र उपयुक्त कोशिका के खिलाफ प्रतिक्रिया करता है। ऐसी अभिक्रियाएं प्रत्यारोपित कोशिकाओं को नष्ट करके गाँठ कोशिका ग्राफ्टिंग के खिलाफ सुरक्षा करती हैं संयुक्त राज्य अमेरिका में, प्रतिवर्ष लगभग 3500 गर्भवती महिलाओं में दुर्दमता पायी जाती है, प्लेसंटा (अपरा) के माध्यम से मां से भ्रूण में तीव्र रक्त कैंसर, लिम्फोमा, मेलानोमा और कार्सिनोमा के संचरण को देखा गया है।[26] अंग प्रत्यारोपण के द्वारा दाता से व्युत्पन्न गाँठ बहुत कम पायी जाती है।
अंग प्रत्यारोपण से सम्बंधित गाँठ का मुख्य कारण है दुर्दम मेलानोमा, जो अंग को हटाने के समय ज्ञात नहीं था,[27] हालांकि अन्य मामले उपस्थित थे[28].
वास्तव में, एक जीव से कैंसर आमतौर पर उसी प्रजाति के दूसरे जीव में तभी वृद्धि करता है जब उन दोनों में समान उतक असंगति के जीन हों[29], चूहों का उपयोग करके ऐसा सिद्ध किया गया है; हालांकि ऊपर वर्णित स्थिति के अलावा वास्तविक दुनिया में ऐसा कभी नहीं होता है।
मानव के अलावा अन्य जीवों में कुछ ऐसे प्रकार के कैंसर पाए गए हैं जो खुद गाँठ की कोशिकाओं के संचरण के द्वारा होते हैं। यह घटना स्टिकर सार्कोमा से युक्त कुत्तों में देखि गयी है, जो केनायन ट्रांसमिसिबल वेनरल ट्यूमर[30] और तस्मानियन डेविल में डेविल चेहरे के ट्यूमर की बीमारी के रूप में भी जानी जाती है।
क्रिया प्रणाली[संपादित करें]

कैंसर मूलरूप में ऊतक विकास के विनियमन का एक रोग है। एक सामान्य कोशिका को कैंसर कोशिका में रूपांतरित करने के लिए, कोशिका वृद्धि और विभेदन को नियमित करने वाले जीनों में रूपांतरण होना चाहिए। [31] आनुवंशिक परिवर्तन कई स्तरों पर हो सकते हैं, ये पूर गुणसूत्र के लाभ या हानि के रूप में हो सकते हैं, जो उत्परिवर्तन का ही एक रूप है और एक मात्र DNA न्युक्लिओटाइड को प्रभावित करता है।
जीन की दो व्यापक श्रेणियां हैं, जो इन परिवर्तनों से प्रभावित होती हैं।ओंकोजीन सामान्य जीन हो सकते हैं, जो अनुपयुक्त रूप से उच्च स्तर पर प्रकट होते हैं, या परिवर्तित जीन जिनमें नोवल गुण होते हैं। किसी भी मामले में, इन जीनों की अभिव्यक्ति कैंसर की कोशिकाओं के दुर्दम लक्षण प्रारूप को बढ़ावा देती है। गांठ का शमन करने वाले जीन वे जीन है जो कैंसर की कोशिकाओं के कोशिका विभाजन, अस्तित्व, या अन्य गुणों को संदमित करते हैं। गांठ का शमन करने वाले जीन अक्सर कैंसर को बढ़ावा देने वाले आनुवंशिक परिवर्तनों के द्वारा अक्षम हो जाते हैं। आमतौर पर, एक सामान्य कोशिका को कैंसर कोशिका में रूपांतरित करने के लिए कई जीनों में परिवर्तन होने जरुरी हैं।[32]
विभिन्न जीनोमिक परिवर्तनों के लिए एक विविध वर्गीकरण योजना है, जो कैंसर कोशिकाओं के उत्पादन में योगदान कर सकती है। इन में से अधिकांश परिवर्तन उत्परिवर्तन होते हैं, या जीनोमिक DNA के न्युक्लियोटाइड अनुक्रमण में परिवर्तन होते हैं। एन्युप्लोइडी, गुणसूत्रों की एक असामान्य संख्या की उपस्थिति, एक जीनोमिक परिवर्तन है, जो एक उत्परिवर्तन नहीं है और इसमें समसूत्री विभाजन में त्रुटि के द्वारा एक या अधिक गुणसूत्रों का लाभ या हानि शामिल हो सकती है।
बड़े पैमाने के उत्परिवर्तनो में शामिल हैं एक गुणसूत्र के एक भाग की क्षति या वृद्धि. जीनोमिक प्रवर्धन तब होता है जब एक कोशिका एक छोटे गुणसूत्री लोकस की कई प्रतिलिपियां (प्रायः 20 या अधिक) प्राप्त कर लेती है, सामान्यतया इसमें एक या अधिक ओंकोजीन होते हैं और आसन्न आनुवंशिक सामग्री होती है।स्थानीकरण (ट्रांसलोकेशन) तब होता है जब दो अलग अलग गुणसूत्री क्षेत्र असामान्य रूप से, एक विशिष्ट स्थान पर संगलित हो जाते हैं। इसका एक जाना माना उदाहरण है फिलाडेल्फिया गुणसूत्र या गुणसूत्र 9 और 22 का स्थानीकरण, जो तीव्र मज्जा जनित रक्त कैंसर में होता है, इसके परिणामस्वरूप BCR-abl संग्लन प्रोटीन, एक ओंकोजेनिक टायरोसिन काइनेज का उत्पादन होता है।
छोटे पैमाने के उत्परिवर्तनों में शामिल हैं बिंदु उत्परिवर्तन, कमी या बढोतरी, जो एक जीन के प्रवर्तक में हो सकती है, यह इसकी अभिव्यक्ति को प्रभावित करती है। या जीन के अनुक्रम कोडन में हो सकती है और इसके प्रोटीन उत्पाद के स्थायित्व या क्रिया को रूपांतरित कर सकती है। एकमात्र जीन का विघटन, एक DNA (डीएनए) वायरस या रिट्रो वायरस से जीनोमिक सामग्री के एकीकरण के परिणामस्वरुप हो सकता है और इस प्रकार की घटना के परिणामस्वरूप प्रभावित कोशिका और उसकी संतति में वायरल ओंकोजीन की अभिव्यक्ति हो सकती है।
अधि-अनुवांशिकी[संपादित करें]
अधि-अनुवांशिकी, DNA (डीएनए) सरंचना में रासायनिक, गैर उत्परिवर्तनीय परिवर्तनों के माध्यम से जीन अभिव्यक्ति के नियमन का अध्ययन है।
कैंसर रोगजनन में अधि-अनुवांशिकी का सिद्धांत है कि DNA (डीएनए) में गैर उत्परिवर्तनीय परिवर्तन जीन अभिव्यक्ति में परिवर्तन कर देते हैं।
सामान्य रूप से, ओंकोजीन शांत होते हैं, उदाहरण के लिए ऐसा DNA (डीएनए) मेथिलिकरण के कारण होता है। इस मेथिलिकरण में क्षति ओंकोजीन की विपथी अभिव्यक्ति को प्रेरित करती है, जो कैंसर रोगजनन का कारण है। अधि-अनुवांशिक परिवर्तन की ज्ञात प्रणाली में शामिल है डीएनए मेथिलिकरण और गुणसूत्र के DNA (डीएनए) पर विशेष स्थिति पर जुड़े हुए हिस्टोन प्रोटीन का मेथिलिकरण या एसिटिलीकरण.
चिकित्सा के वर्ग जो HDAC संदमक और DNA (डीएनए) मिथाइल ट्रांसफरेज संदमक के रूप में जाने जाते हैं, वे कैंसर कोशिका में अधि-अनुवांशिक संकेतन को पुनः नियमित कर सकते हैं।
ओंकोजीन्स[संपादित करें]
ओंकोजीन कई प्रकार से कोशिका वृद्धि को बढ़ावा देते है। कई हार्मोन बना सकते हैं, यह कोशिकाओं के बीच एक रासायनिक संदेशवाहक होता है जो समसूत्री विभाजन को प्रेरित करता है, जिसका प्रभाव ग्राही उतक या कोशिका के संकेत पारगमन पर निर्भर करता है। दूसरे शब्दों में, जब एक प्राप्तकर्ता कोशिका पर एक हार्मोन ग्राही उत्तेजित होता है, संकेत कोशिका की सतह से कोशिका के केन्द्रक को संवहित होता है, यह केन्द्रीय स्तर पर जीन प्रतिलेखन विनियमन में कुछ परिवर्तनों को प्रभावित करता है। कुछ ओंकोजीन ख़ुद संकेत पारगमन तंत्र का भाग होते हैं, या कोशिकाओं और ऊतकों में संकेत ग्राही का एक भाग होते हैं, इस प्रकार से ऐसे होर्मोनों की संवेदनशीलता को नियंत्रित करते हैं। ओंकोजीन अक्सर समसूत्रजन उत्पन्न करते हैं, या प्रोटीन संश्लेषण में DNA (डीएनए) के प्रतिलेखन में संलग्न होते हैं, जो प्रोटीन और एंजाइम बनाता है, ये प्रोटीन और एंजाइम उन उत्पादों और जैव रसायनों के निर्माण के लिए उत्तरदायी हैं, जिनके साथ कोशिकाएं अंतर्क्रिया करती हैं और जिनका कोशिकाएं उपयोग करती हैं।
आद्य-ओन्कोजीन में उत्परिवर्तन, जो सामान्यतया ओन्कोजीन के स्थिर समकक्ष हैं, उनकी अभिव्यक्ति और क्रिया को संशोधित कर सकते हैं और उत्पाद प्रोटीन की क्रिया या मात्रा को बढ़ाते हैं। जब ऐसा होता है, आद्य-ओन्कोजीन ओन्कोजीन बन जाते हैं और यह संक्रमण कोशिका में कोशिका चक्र विनियमन के सामान्य संतुलन को बिगाड़ देता है, जिससे अनियंत्रित कोशिका वृद्धि संभव हो जाती है।
चाहे संभव भी हो जाये तो भी जीनोम में से आद्य-ओंकोजीन को हटा कर कैंसर कि संभावना को कम नहीं किया जा सकता है, क्योंकि वे जीव की वृद्धि, मरम्मत और समस्थापन के लिए जटिल होते हैं। ऐसा केवल तब होता है जब वे उत्परिवर्तित हो जाते हैं और वृद्धि के संकेत अत्यधिक हो जाते हैं।
कैंसर अनुसंधान में परिभाषित किये जाने वाले पहले ओंकोजीनों में से एक है रास ओंकोजीन.आद्य-ओंकोजीन के रास परिवार (H-रास, N-रास और K-रास) में उत्परिवर्तन बहुत आम हैं, ये सभी मानव गांठों के 20% से 30% में पाए जाते हैं।[33] रास को मूल रूप से हार्वे सार्कोमा वायरस जीनोम में पहचाना गया था और शोधकर्ता इस बात से आश्चर्यचकित हो गए कि न केवल मानव जीनोम में यह जीन उपस्थिति था बल्कि, एक उत्प्रेरक नियंत्रण तत्व से जुड़ा हुआ था, जो कोशिका रेखा संवर्धन में कैंसर को प्रेरित कर सकता था।[34]
गाँठ का शमन करने वाले जीन[संपादित करें]
गाँठ का शमन करने वाला जीन प्रचुरोदभवन विरोधी संकेतों और प्रोटीनों के लिए अनुकोडन करता है, जो समसूत्री विभाजन और कोशिका वृद्धि का शमन कर देते हैं।
सामान्यतः, गाँठ का शमन करने वाले जीन प्रतिलेखन कारक हैं जो कोशिकीय तनाव या DNA (डीएनए) क्षति के द्वारा सक्रिय होते हैं। अक्सर DNA (डीएनए) क्षति के कारण मुक्त-उत्प्लावी आनुवंशिक पदार्थ की उपस्थिति और साथ ही अन्य लक्षण देखे जा सकते हैं, जो ऐसे एंजाइमों और मार्ग को प्रेरित करते हैं जो गाँठ का शमन करने वाले जीन के सक्रियण के लिए उत्तरदायी है। ऐसे जीनों का कार्य है DNA (डीएनए) की मरम्मत के लिए कोशिका चक्र के आगे बढ़ने पर नियंत्रण, जो उत्परिवर्तन को पुत्री कोशिका तक स्थानांतरित होने से रोकता है।p53 प्रोटीन, जो सबसे ज्यादा अध्ययन किये गए गाँठ का शमन करने वाले जीनों में से एक है, एक प्रतिलेखन कारक है जो हाइपोक्सिया और पराबैंगनी विकिरण क्षति सहित कई कोशिकीय तनावकारियों के द्वारा सक्रिय होते हैं।
p53 रूपांतरण में शामिल सभी कैंसरों के लगभग आधे के अलावा, इसके गाँठ के शमन कार्य को भली प्रकार से समझा नहीं गया है। स्पष्ट रूप से p53 के दो कार्य हैं: एक प्रतिलेखन कारक के रूप में एक नाभिकीय भूमिका और दूसरा कोशिका चक्र, कोशिका विभाजन और एपोपटोसिस विनियमन में कोशिका द्रव्यी भूमिका.
वारबर्ग परिकल्पना के अनुसार कैंसर की वृद्धि के लिए उर्जा हेतु ग्लाइकोलाइसिस का अधिमान्य प्रयोग होता है। p53 श्वसन से ग्लाइकोलाइटिक पथ को स्थानांतरण का नियमन करता है।[35]
हालांकि, एक उत्परिवर्तन, ख़ुद "इसे बंद करते हुए" गाँठ का शमन करने वाले जीन को या इस संकेत मार्ग को क्षति पहुँचा सकता है, जो इसे सक्रिय करता है, इस का अचल परिणाम है कि DNA (डीएनए) की मरम्मत बाधित या संदमित हो जाती है: मरम्मत रहित डीएनए क्षति का संग्रह निश्चित रूप कैंसर का कारण बनता है।
गाँठ का शमन करने वाले जीनों के उत्परिवर्तन जो जनन स्तर कोशिकाओं में उत्पन्न होते हैं, वे संतति में स्थानांतरित हो जाते हैं और अगली पीढियों में कैंसर की संभावना को बढा देते हैं।
इन परिवारों के सदस्यों ने ऐसी घटनाओं में वृद्धि की है और इससे बहुल ट्यूमर की विलंबता में कमी आई है। गाँठ के प्रकार गाँठ का शमन करने वाले उत्परिवर्तन के प्रत्येक प्रकार के लिए प्रारूपिक होते हैं, कुछ उत्परिवर्तन विशेष प्रकार के कैंसर का कारण हैं, जबकि अन्य उत्परिवर्तन अन्य प्रकार के कैंसर का कारण हैं। उत्परिवर्ती ट्यूमर शामक की वंशागति का प्रकार यह है कि एक प्रभावी सदस्य एक दोषपूर्ण प्रतिलिपि को एक जनक से और सामान्य प्रतिलिपि को दूसरे जनक से प्राप्त करता है। उदाहरण के लिए, एक व्यक्ति जो एक उत्परिवर्ती p53 एलील को वंशागत रूप से प्राप्त करता है (और इसलिए उत्परिवर्तित p53 के लिए विषम युग्मजी है) वह मेलानोमा और अग्नाशयी कैंसर विकसित कर सकता है जो ली-फ्रामेनी सिंड्रोम कहलाता है। अन्य वंशागत गाँठ का शमन करने वाले जीन सिंड्रोम में शामिल है रेटिनो ब्लास्टोमा से सम्बंधित Rb उत्परिवर्तन और ऐडिनोपोलीपोसिस बड़ी आंत के कैंसर से जुड़े APC जीन उत्परिवर्तन.ऐडिनोपोलीपोसिस बड़ी आंत का कैंसर बचपन की अवस्था में बड़ी आंत में हजारों पोलिप से सम्बंधित हैं, जो अपेक्षाकृत कम उम्र में बड़ी आंत का कैंसर उत्पन्न करते हैं। अंत में, BRCA1 और BRCA2 में वंशागत उत्परिवर्तन स्तन कैंसर की प्रारंभिक शुरुआत का कारण बनते हैं।
1971 में यह प्रस्ताव दिया गया कि कैंसर का विकास कम से कम दो उत्परिवर्तन घटनाओं पर निर्भर करता है। नुडसन की दो चोट की परिकल्पना के अनुसार एक गाँठ का शमन करने वाले जीन में एक वंशागत जनन स्तर उत्परिवर्तन कैंसर को केवल तभी उत्पन्न करेगा जब जीव के जीवन में बाद में कोई अन्य उत्परिवर्तन घटित होता है, यह उस गाँठ का शमन करने वाले जीन के अन्य एलील को निष्क्रिय कर देगा। [36]
आमतौर पर, ओंकोजीन प्रभावी होते हैं, क्योंकि उनमें क्रिया-का-लाभ उत्परिवर्तन शामिल होता है, जबकि उत्परिवर्तित ट्यूमर शामक अप्रभावी होते हैं, क्योंकि उनमें क्रिया-की-हानि उत्परिवर्तन शामिल होता है। हर कोशिका में समान जीन की दो प्रतिलिपियां होती हैं, इनमें से प्रत्येक प्रतिलिपि अभिभावक से प्राप्त की जाती है और अधिकांश मामलों के अंतर्गत एक विशेष प्रोटो-ओंकोजीन की केवल एक प्रतिलिपि में क्रिया-का-लाभ उत्परिवर्तन, उस जीन को एक वास्तविक ओंकोजीन बनाने के लिए पर्याप्त होता है। दूसरी ओर, क्रिया-की-हानि उत्परिवर्तन का, गाँठ का शमन करने वाले जीन की दोनों प्रतिलिपियों में होना आवश्यक है ताकि जीन को पूरी तरह से क्रियाहीन बनाया जा सके। हालांकि, ऐसे मामले हैं जिनमें गाँठ का शमन करने वाले जीन की एक उत्परिवर्तित प्रतिलिपि अन्य जंगली-प्रकार प्रतिलिपि को क्रियाहीन बना देती है। यह घटना प्रभावी नकारात्मक प्रभाव कहलाती है और कई p53 उत्परिवर्तनों में देखी जाती है।
नुडसन के दो चोट के मोडल को हाल ही में कई जांचकर्ताओं द्वारा चुनौती दी गई है। गाँठ का शमन करने वाले कुछ जीनों के एक एलील का निष्क्रियकरण ट्यूमर को उत्पन्न करने के लिए पर्याप्त है। यह घटना अगुणित अपर्याप्तता कहलाती है और इसे कई प्रयोगात्मक दृष्टिकोणों के द्वारा प्रदर्शित किया गया है।अगुणित अपर्याप्तता से उत्पन्न हुई गाँठ की शुरुआत आम तौर पर देर से होती है, जब इसकी तुलना एक एक दो चोट की प्रक्रिया से की जाती है।[37]
कैंसर कोशिका जीव विज्ञान[संपादित करें]

अक्सर, बहुल आनुवंशिक परिवर्तन जिनका परिणाम कैंसर होता है, उन्हें संचित होने में कई साल लग सकते हैं। इस समय के दौरान, पूर्व दुर्दम कोशिकाओं का जैविक व्यवहार धीरे धीरे सामान्य कोशिका से बदल कर कैंसर कोशिका का हो जाता है। सूक्ष्मदर्शी की सहायता से पूर्व दुर्दम ऊतक में विभेदक गुण देखे जा सकते हैं। विभेदक लक्षणों में है विभाजित होती हुई कोशिकाओं की बढ़ी हुई संख्या, केन्द्रक के आकार और आकृति में भिन्नता, कोशिका के आकार और आकृति में भिन्नता, विशिष्टीकृत कोशिकाओं के गुणों में कमी और सामान्य उतक संगठन की क्षति. दुर्विकासिता (डिस्प्लेजिया) अतिरिक्त कोशिका प्रचुरोद भवन का एक असामान्य प्रकार है जो सामान्य उतक व्यवस्था तथा पूर्व दुर्दम कोशिकाओं में कोशिका सरंचना की हानि के द्वारा परिलक्षित होता है। ये प्रारंभिक अर्बुदीय (निओप्लास्टिक) परिवर्तन अतिवर्धन (हाइपरप्लाजिया) से विभेदित किए जाने चाहियें, जो एक बाहरी उद्दीपन के कारण कोशिका विभाजन में एक उत्परिवर्ती वृद्धि है, जैसे होर्मोनी असंतुलन या पुरानी जलन.
दुर्विकासिता के सबसे गंभीर मामलों को "स्वस्थानी कर्कार्बुद (कार्सिनोमा)" कहा जाता है। लैटिन में, "स्वस्थानी (in situ)" शब्द का अर्थ है "स्थान में", इसलिए कार्सिनोमा स्वस्थानी शब्द का अर्थ है कोशिकाओं की अनियंत्रित वृद्धि जो अपने मूल स्थान पर ही बनी रहती है और जिसने अन्य उतकों पर कोई आक्रमण नहीं दर्शाया है।
फिर भी, कार्सिनोमा स्वस्थानी एक आक्रामक दुर्दमता में विकसित हो सकता है और यदि सम्भव हो तो इसे आम तौर पर शल्य क्रिया के द्वारा हटा दिया जाता है।
क्लोनी विकास[संपादित करें]
जिस तरह से जानवरों की आबादी में विकास होता है, ठीक उसी तरह कोशिकाओं की अनियंत्रित आबादी में भी विकास होता है। यह अवांछनीय प्रक्रिया कायिक विकास कहलाती है और इसी तरह से कैंसर उत्पन्न होता है और अधिक दुर्दम बन जाता है।[38]
कोशिकीय उपापचय में अधिकांश परिवर्तन जो कोशिका में अनियमित तरीके से विभाजन का कारण हैं, वे कोशिका मृत्यु का कारण होते हैं। हालांकि एक बार कैंसर शुरू हो जाने पर, कैंसर की कोशिकाएं प्राकृतिक वरण की एक प्रक्रिया से होकर गुजरती हैं: नए आनुवंशिक परिवर्तनों से युक्त कुछ कोशिकाएं जो अपने जीवन और प्रजनन को बढ़ावा देने के लिए निरंतर बहुगुणित होती रहती हैं और जल्दी ही विकसित होती हुई गाँठ पर प्रभावी हो जाती हैं, क्योंकि कम अनुकूलित आनुवंशिक परिवर्तनों से युक्त कोशिकाएं प्रतिस्पर्धा से बाहर होती हैं।[39] इसी प्रकार से MRSA जैसे रोगजनक प्रतिजैविक-प्रतिरोधी बन जाते हैं (या इसी प्रकार से HIV ड्रग-प्रतिरोधी बन जाता है) और यही कारण है कि फसलों के ब्लाईट और कीट कीटनाशक प्रतिरोधी बन जाते हैं। इसी विकास के कारण कैंसर पुनरावृति में ऐसी कोशिकाएं होती हैं जो कैंसर की दवाओं के लिए प्रतिरोध प्राप्त कर लेती हैं (या कुछ मामलों में विकिरण चिकित्सा के विकिरणों के लिए प्रतिरोधी हो जाती हैं)
कैंसर की कोशिकाओं के जैविक गुण[संपादित करें]
हनाहन और वीनबर्ग के द्वारा 2000 में दिए गए एक लेख में, दुर्दम गाँठ कोशिकाओं के जैविक गुणों को निम्नानुसार संक्षेप में बताया गया:[40]
- वृद्धि के संकेतों में स्वयं-प्रचुरता का अधिग्रहण, जो अनियंत्रित विकास को बढ़ावा देता है।
- वृद्धि विरोधी संकेतों की संवेदनशीलता में क्षति, भी अनियंत्रित विकास का कारण होती है।
- एपोपटोसिस के लिए क्षमता में कमी, जो आनुवंशिक त्रुटियों और बाह्य वृद्धि विरोधी संकेतों के बावजूद, वृद्धि को बढ़ावा देती है।
- जीर्णता के लिए क्षमता में कमी, जो असीमित प्रतिकृति क्षमता का कारण है। (अमरत्व)
- निरंतर वाहिकाजनन का अधिग्रहण, जो निष्क्रिय पोषक प्रसार की सीमाओं से परे ट्यूमर की वृद्धि को बढ़ावा देता है।
- आस पास के ऊतकों पर आक्रमण करने की क्षमता का अधिग्रहण, जो आक्रामक कार्सिनोमा का परिभाषित गुण है।
- सुदूर स्थानों पर अपररूपांतरण (मेटास्टेसिस) के निर्माण की क्षमता का अधिग्रहण, जो दुर्दम गांठ का मुख्य लक्षण है (कार्सिनोमा या अन्य).
इन बहुल पदों का पूरा होना निम्न के बिना एक बहुत ही दुर्लभ घटना होगी:
- आनुवंशिक त्रुटियों की मरम्मत के लिए क्षमता में कमी, जो उत्परिवर्तन दर (जीनोमिक अस्थिरता) को बढाती है, इस प्रकार से सभी अन्य परिवर्तनों को त्वरित करती है।
ये जैविक परिवर्तन कार्सिनोमा में मुख्य हैं; अन्य दुर्दम गांठों को उन सब की प्राप्ति के लिए सभी की जरुरत नहीं हो सकती है। उदाहरण के लिए, ऊतक आक्रमण और दूर के स्थानों पर विस्थापन श्वेत रक्त कोशिकाओं का सामान्य गुण है; ये पद श्वेतरक्तता (ल्यूकेमिया या रक्त का कर्कट) के विकास के लिए आवश्यक नहीं हैं। विभिन्न पद जरुरी रूप से व्यक्तिगत उत्परिवार्तनों का प्रतिनिधित्व नहीं करते.उदाहरण के लिए, एक वंशाणु (जीन) का निष्क्रियकरण, P53 प्रोटीन के लिए कोडन, जीनोमिक अस्थिरता, एपोपटोसिस और वाहिकाजनन (एन्जियोजिनेसिस) में वृद्धि का कारण होंगे। कैंसर की सभी कोशिकाएं विभाजित नहीं होती हैं। बल्कि, एक गाँठ में कोशिकाओं का एक उप समुच्चय, कर्कट मूल कोशिकाएं (कैंसर स्टेम कोशिकाएं) कहलाता है, जो अपने आप की प्रतिकृति करता है और विभेदित कोशिकाओं का निर्माण करता है।[41]
रोकथाम[संपादित करें]
कैंसर की रोकथाम को, कैंसर की घटनाओं में कमी लाने के लिए सक्रिय उपायों के रूप में परिभाषित किया जाता है। इसके लिए कर्कटजन (कैंसर पैदा करने वाले कारकों) से बचना या उनके उपापचय को परिवर्तित करना, ऐसी जीवन शैली या आहार को अपनाना जो कैंसर पैदा करने वाले कारकों को संशोधित करे और/या चिकित्सा हस्तक्षेप (रासायनिक रोकथाम, पूर्व दुर्दम घावों का उपचार) उपयोगी हो सकता है।
"रोकथाम" की महामारी विज्ञान अवधारणा को सामान्यतया या तो उन लोगों के लिए प्राथमिक रोकथाम के रूप में परिभाषित किया जा सकता है जिनमें किसी विशेष रोग का निदान नहीं किया गया है, या द्वितीयक रोकथाम के रूप में परिभाषित किया जा सकता है, जो पहले से निदान किए गए रोग की जटिलताओं को कम करता है।
संशोधन योग्य ("जीवन शैली") जोखिम कारक[संपादित करें]

कैंसर के जोखिम के अधिकांश कारक पर्यावरण या प्रकृति में जीवन शैली से सम्बंधित हैं, ये दावा करते हैं कि कैंसर व्यापक रूप से रोकथाम किये जाने योग्य एक बीमारी है।[42] संशोधित किये जाने योग्य कैंसर के जोखिम कारकों के उदाहरण हैं एल्कोहल का उपभोग, (जो मुख, ग्रसनी, स्तन के और अन्य प्रकार के कैंसरों के जोखिम के बढ़ने से सम्बंधित है), धुम्रपान (हालांकि 10% पुरुषों की तुलना में फुफ्फुस के कैंसर से युक्त 20% महिलाएं ऎसी होती हैं जिन्होंने कभी भी धुम्रपान नहीं किया होता है[43]), शारीरिक निष्क्रियता (वृहद् आंत्र, स्तन और संभवतया अन्य कैंसरों से सम्बंधित) और बहुत अधिक वजन/ मोटापा होना (वृहद् आंत्र, स्तन, अन्तः गर्भाशय कला और संभवतया अन्य कैंसरों से सम्बंधित).
महामारी विज्ञान साक्ष्य के आधार पर, अब यह माना जाता है कि शराब के बहुत अधिक सेवन से बचना विशेष प्रकार के कैंसरों के जोखिम को कम करने में योगदान देता है; हालांकि तंबाकू की तुलना में, प्रभाव की मात्रा बहुत कम है और प्रमाण की क्षमता अक्सर कमजोर होती है। अन्य जीवन शैली और पर्यावरणीय कारक जो कैंसर के जोखिम को प्रभावित करने के लिए जाने जाते हैं, (या तो लाभदायक या हानिकारक रूप में) में शामिल हैं, विशिष्ट यौन संचारित रोग (जैसे मानव पेपिलोमा वायरस के द्वारा संचरित होने वाले रोग), बहिर्जनित होर्मोनों का उपयोग, आयनीकरण विकिरणों और पराबैंगनी विकिरणों के संपर्क में आना और विशिष्ट व्यवसायिक और रासायनिक पदार्थों के संपर्क में आना.
हर साल पूरी दुनिया में कम से कम 200,000 लोगों की मृत्यु अपने कार्यस्थल से सम्बंधित कैंसर के कारण होती है।[44] कई मिलियन श्रमिक ऐसे हैं जिनमें अपने कार्य स्थल पर निरंतर एस्बेस्टस फाइबर और तम्बाकू के धुएँ के संपर्क में रहने के कारण फुफ्फुस कैंसर और मिजोथेलीओमा की तरह के कैंसर के विकसित होने का ख़तरा होता है या निरंतर बेंजीन के संपर्क में रहने के कारण रक्त कैंसर (ल्यूकेमिया) का ख़तरा रहता है।[44] वर्तमान में, व्यवसायिक जोखिम कारकों की वजह से होने वाले कैंसर के कारण होने वाली मौतें अधिकांशतया विकसित दुनिया में होती हैं।[44] ऐसा अनुमान लगाया गया है कि संयुक्त राज्य अमेरिका में हर साल लगभग 20,000 कैंसर मौतें और कैंसर के 40,000 नए मामले व्यवसाय से सम्बंधित होते हैं।[45]
आहार[संपादित करें]
आहार और कैंसर पर आम सहमति है कि मोटापा कैंसर के खतरे को बढ़ाता है। भिन्न देशों में आहार की भिन्न प्रथाएं अक्सर कैंसर की घटनाओं में अन्तर को स्पष्ट करती हैं, (उदाहरण आमाशय का कैंसर जापान में आम है, जबकि बड़ी आँत का कैंसर संयुक्त राज्य अमेरिका में आम है। इस उदाहरण में अगुणित समूहों के पूर्ववर्ती विचार शामिल नहीं हैं).अध्ययनों से पता चला है कि अप्रवासी अक्सर एक पीढी तक ही नए देश के जोखिम को विकसित कर लेते हैं, इसके लिए आहार और कैंसर के बीच महत्वपूर्ण कड़ी की संभावना को व्यक्त किया गया है।[46] एक आबादी में मोटापे का कम होना कैंसर की घटनाओं को भी कम करता है यह अज्ञात है।
कैंसर के जोखिम पर विशेष पदार्थों (भोजन सहित) के लाभकारी और हानिकारी प्रभावों की रिपोर्टों के बावजूद, इनमें से बहुत कम ऐसे हैं जिनके साथ कैंसर के सम्बन्ध को स्थापित किया जा चुका है।
ये रिपोर्टें अक्सर संवर्धित कोशिका माध्यम या जंतुओं में किये गए अध्ययन पर आधारित होती हैं। सार्वजनिक स्वास्थ्य सिफारिशों को इन अध्ययनों के आधार पर नहीं बनाया जा सकता है, जब तक वे मानव में परीक्षण (या कभी कभी एक अवलोकन हस्तक्षेप) में सही साबित न हो जायें.

महामारी विज्ञान संघ के अध्ययन अक्सर प्राथमिक कैंसर के खतरे को कम करने के लिए प्रस्तावित पथ्य हस्तक्षेप का पक्ष लेते हैं। इस तरह के अध्ययन के उदाहरण हैं, वे रिपोर्टें जो बताती हैं कि मांस का उपभोग कम करने से वृहद् आंत्र के कैंसर का जोखिम कम हो जाता है,[47] और रिपोर्टें कि कॉफी का सेवन यकृत कैंसर के खतरे को कम करता है।[48] अध्ययनों के द्वारा ग्रिल्ड मांस के उपभोग को[49][49] बृहदान्त्र कैंसर,[50] स्तन कैंसर,[51] और अग्नाशय के कैंसर,[52] के जोखिम के बढ़ने से सम्बंधित किया गया है, ऐसा उच्च ताप पर पकाए जाने वाले भोजन में कार्सिनोजन जैसे बेन्जोपायरीन की उपस्थिति के कारण होता है।
2005 का एक द्वितीयक रोकथाम अध्ययन दर्शाता है कि जीवन शैली में परिवर्तन और पौधों पर आधारित आहार के सेवन से प्रोस्टेट कैंसर के रोगी पुरुषों के एक समूह में कैंसर में कमी आई जो उस समय पर किसी परंपरागत उपचार का उपयोग नहीं कर रहे थे।[53]
इन परिणामों को 2006 के अध्ययन से अधिक महत्त्व मिला जिसमें 2400 से अधिक महिलाओं पर अध्ययन किया गया, इस दौरान इनमें से आधी महिलाओं को सामान्य आहार पर रखा गया और शेष को ऐसा आहार दिया गया जिसमें वसा की कैलोरी 20% से कम हो। दिसम्बर, 2006 की अंतरिम रिपोर्ट में बताया गया कि कम वसा आहार पर रखी गई महिलाओं में स्तन कैंसर पुनरावृत्ति की मात्रा कम थी।[54]
हाल के अध्ययनों से कैंसर के कुछ रूपों और परिष्कृत शर्करा और अन्य साधारण कार्बोहाईड्रेट के उच्च उपभोग के बीच संभावित कड़ी को प्रदर्शित किया गया है।[55][56][57][58][59] हालांकि संबंधों के अंश और केजुअल्टी के अंश विवाद का मुद्दा हैं,[60][61][62] दरअसल कुछ संगठन कैंसर के निवारण के लिए परिष्कृत शर्करा और स्टार्च की खपत को कम करने की सिफारिश करते हैं।[63][64][65]
नवंबर 2007 में, अमेरिकन इंस्टीट्यूट फॉर कैंसर रिसर्च (AICR), ने वर्ल्ड कैंसर रिसर्च फंड (WCRF) के सहयोग से फ़ूड, न्यूट्रीशियन, फिजिकल एक्टिविटी एंड दी प्रिवेंशन ऑफ़ कैंसर: अ ग्लोबल पर्सपेक्टिव का प्रकाशन किया, "जो आहार, शारीरिक क्रिया और कैंसर पर सबसे वर्तमान और व्यापक विश्लेषण है".[66] WCRF / AICR विशेषज्ञ रिपोर्ट 10 सलाहों की सूची देती है जिनका इस्तेमाल लोग कैंसर के विकास के जोखिम को कम करने के लिए कर सकते हैं, जिसमें आहार के निम्न दिशानिर्देश शामिल हैं: (1) ऐसे खाद्य और पेय पदार्थों के सेवन को कम करना जो वजन बढ़ाते हैं, नामतः अधिक ऊर्जा युक्त खाद्य और शर्करा युक्त पेय, (2) अधिकतर पादप उत्पत्ति के खाद्य का उपभोग, (3) लाल मांस के सेवन को सीमित करना और उपचारित मांस से परहेज करना, (4) एल्कोहल युक्त पेय पदार्थों के उपभोग को सीमित करना और (5) नमक के सेवन को कम करना और कालातीत अनाज (अन्न) या दालों (फलियों) से परहेज करना। [67][68]
विटामिन[संपादित करें]
प्रारंभिक प्रेक्षणों से प्राप्त विचार कि विटामिन पूरक स्टेम के माध्यम से कैंसर की रोकथाम की जा सकती है, मानव रोगों को विटामिनों की कमी से सम्बंधित करता है, जैसे प्राणाशी रक्ताल्पता विटामिन B12 की कमी से सम्बंधित होता है और स्कर्वी विटामिन सी की कमी से सम्बंधित होता है।
यह व्यापक रूप से कैंसर के साथ सही साबित नहीं हुआ है और व्यापक रूप से विटामिन अनुपूरण कैंसर की रोकथाम में प्रभावी नहीं साबित नहीं हुआ है।
भोजन के कैंसर से लड़ने वाले अवयव पहले की तुलना में अब अधिक असंख्य और विविध माने जाते हैं, अतः अब रोगियों को ज़्यादा से ज़्यादा स्वास्थ्य लाभ के लिए बड़े पैमाने पर ताजा, अप्रसंस्कृत फल और सब्जियों के उपभोग की सलाह दी जाती है।[69]
महामारी विज्ञान के अध्ययन दर्शाते हैं कि विटामिन D की कमी कैंसर के जोखिम के बढ़ने से सम्बंधित है।[70][71] हालांकि, इस तरह के अध्ययनों के परिणाम सावधानी से उपचारित किये जाने चाहिए, क्योंकि वे यह नहीं दर्शा सकते कि दो कारकों के बीच सम्बन्ध का अर्थ है कि एक दूसरे का कारण है (अर्थात सम्बन्ध कारण की और संकेत नहीं करता है)[72] यह संभावना कि विटामिन D कैंसर से रक्षा करता है, इस तथ्य के विपरीत है कि धुप के संपर्क में रहने पर दुर्दमता का जोखिम बढ़ जाता है।
सूर्य के संपर्क में रहने से मनुष्य में विटामिन D के प्राकृतिक उत्पादन में वृद्धि हो जाती है, कुछ कैंसर अनुसंधानकर्ताओं ने तर्क दिया है कि सूर्य के संपर्क में रहने वाली त्वचा में अतिरिक्त विटामिन D संश्लेषण के कैंसर निवारणीय प्रभाव के तुलना में दुर्दमता के प्रभाव के बढ़ने की संभावना अधिक हानिकर होती है। 2002 में, डॉ॰ विलियम बी ग्रांट ने दावा किया कि अमेरिका में सालाना 23,800 समयपूर्व कैंसर मौतों का कारण है अपर्याप्त UVB के संपर्क में रहना (जाहिर तौर पर विटामिन D की कमी).[73] यह संख्या मेलेनोमा या स्क्वैमस सेल कार्सिनोमा के कारण हुई 8800 मौतों से कम है, इसलिए कुल मिलाकर सूर्य के संपर्क में रहना लाभकारी ही है।
एक अन्य शोध समूह[74][75] अनुमान है कि संयुक्त राज्य अमेरिका में 50,000-63,000 और ब्रिटेन में 19,000- 25,000 व्यक्ति विटामिन D की कमी के कारण प्रतिवर्ष समय पूर्व कैंसर से मर जाते हैं।
बीटा कैरोटीन का मामला यद्रिच्चिक नैदानिक परीक्षणों के महत्त्व का एक उदाहरण देता है। आहार और सीरम के स्तरों पर अध्ययन करने वाले महामारी विज्ञानीयों के अनुसार विटामिन A के पूर्ववर्ती बीटा कैरोटीन के उच्च स्तर, एक सुरक्षात्मक प्रभाव से, सम्बंधित हैं जो कैंसर के जोखिम को कम करते हैं। यह प्रभाव विशेष रूप से फेफड़ों के कैंसर में अधिक प्रबल है। इस परिकल्पना के आधार पर 1980 और 1990 के दशकों के दौरान फ़िनलैंड और संयुक्त राज्य अमेरिका में कई नैदानिक परीक्षण एक श्रृंखला में किए गए।
इस अध्ययन में 80,000 धूम्रपान करने वालों या पूर्व धूम्रपान वालों को प्लेसबो या बीटा-केरोटीन का दैनिक पूरक आहार उपलब्ध कराया गया।
उम्मीद के विपरीत, इस परीक्षण के दौरान दिए गए बीटा केरोटीन के पूरक आहार ने फुफ्फुस कैंसर की घटनाओं या मृत्यु दर को कम करने में कोई भूमिका नहीं निभायी. वास्तव में, बीटा कैरोटीन, के द्वारा फेफड़ों के कैंसर का खतरा बहुत अधिक नहीं लेकिन बहुत कम बढ़ा, इसने प्रारंभिक अध्ययन को यहीं पर समाप्त कर दिया। [76]
जर्नल ऑफ अमेरिकन मेडिकल एसोसिएशन (JAMA) की 2007 में दी गई रिपोर्ट के परिणाम सूचित करते हैं कि फोलिक अम्ल के पूरक आहार बड़ी आँत के कैंसर को रोकने में प्रभावी नहीं हैं और फोलेट का उपभोग करने वालों में बड़ी आँत के पोलिप के बनने की संभावना अधिक होती है।[77]
रासायनिक रोकथाम[संपादित करें]
यह एक आकर्षक अवधारणा है कि कैंसर को रोकने के लिए दवाओं का इस्तेमाल किया जा सकता है और कई उच्च श्रेणी के नैदानिक परिक्षण सलाह देते हैं कि ऐसे रासायनिक रोकथाम को विशेष परिस्थितियों में काम में लेना चाहिए।
प्रारूपिक रूप से 5 वर्ष के लिए एक चयनात्मक एस्ट्रोजन रिसेप्टर मोड्युलेटर (SERM), टेमोक्सीफेन का दैनिक उपयोग उच्च जोखिम युक्त महिलाओं में स्तन कैंसर के खतरे को लगभग 50% तक कम कर देता है। हाल ही के अध्ययन की एक रिपोर्ट के अनुसार चयनात्मक एस्ट्रोजन रिसेप्टर मोड्युलेटर रेलोक्सिफ़ेन भी टेमोक्सीफेन की तरह ही लाभकारी है और उच्च जोखिम युक्त महिलाओं में स्तन कैंसर के खतरे को कम करता है इसके पार्श्व प्रभावों का प्रोफाइल अधिक अनुकूल है।[78]
रेलोक्सिफ़ेन टेमोक्सीफेन की तरह एक SERM है; उच्च जोखिम युक्त महिलाओं में स्तन कैंसर के खतरे को कम करने में यह टेमोक्सीफेन के समान ही प्रभावी (STAR परीक्षण में) पाया गया है। इस परीक्षण में लगभग 20,000 महिलाओं पर अध्ययन किया गया, रेलोक्सिफ़ेन के पार्श्व प्रभाव टेमोक्सीफेन से कम हैं, यद्यपि यह अधिक DCIS बनाने के लिए प्रक्रिया को बढ़ावा देता है।[78]
एक 5-अल्फा-रिड़कटेज संदमक फिनएस्टेराइड, प्रोस्टेट कैंसर के खतरे को कम करता है, यद्यपि यह छोटी श्रेणी के ट्यूमर को अधिकांशतया रोक देता है।[79] बृहदान्त्र पोलिप्स के जोखिम पर कॉक्स-2 संदमक जैसे रोफेकोक्सिब और सलेकोक्सिब के प्रभाव का अध्ययन फेमिलियल एडिनोमेटस पोलीपोसिस रोगियों में[80] और आम जनसंख्या में किया गया है।[81][82] दोनों समूहों में, बृहदान्त्र पोलिप की घटना में बहुत कमी आई, लेकिन इसका असर हृदय संवहनी विषाक्तता की वृद्धि के रूप में दिखाई दिया।
आनुवंशिक परीक्षण[संपादित करें]
विशेष कैंसर संबंधी आनुवंशिक उत्परिवर्तनों के लिए उच्च जोखिम युक्त व्यक्तियों का आनुवंशिक परीक्षण पहले से ही उपलब्ध है। आनुवंशिक उत्परिवर्तनों के वाहक जो कैंसर के जोखिम की घटनाओं को बढाते हैं, उन पर अधिक निगरानी रखी जा सकती है, उनके लिए रासायनिक रोकथाम या जोखिम को कम करने वाली शल्य चिकित्सा का उपयोग किया जा सकता है। कैंसर के वंशागत जोखिम की प्रारंभिक पहचान और कैंसर की रोकथाम के उपाय जैसे शल्य चिकित्सा या निगरानी, उच्च जोखिम वाले व्यक्तियों के जीवन के लिए बहुत अधिक लाभकारी हो सकते हैं।
| जीन | कैंसर के प्रकार | उपलब्धता |
|---|---|---|
| BRCA1, BRCA2 | स्तन, डिम्बग्रंथि, अग्नाशयी | नैदानिक नमूनों के लिए व्यावसायिक रूप से उपलब्ध |
| MLH1, MSH2, MSH6, PMS1, PMS2 | बृहदान्त्र, गर्भाशय, छोटी आंत, आमाशय, मूत्रमार्ग | नैदानिक नमूनों के लिए व्यावसायिक रूप से उपलब्ध |
टीकाकरण[संपादित करें]
ओंकोजनिक संक्रामक कारक जैसे वायरस के द्वारा संक्रमण को रोकने के लिए रोग निरोधी वेक्सिनों या टीकों का विकास किया गया है और कैंसर विशिष्ट एपिटोप्स के खिलाफ प्रतिरक्षी प्रतिक्रिया को उत्तेजित करने के लिए चिकित्सात्मक टीकों का विकास किया जा रहा है।[83]
जैसा की ऊपर बताया गया है कि एक निवारक मानव पेपिलोमा वायरस वेक्सीन उपस्थित है जो मानव पेपिलोमा वायरस की विशिष्ट यौन संचरित नस्लों को लक्ष्य बनाता है, जो गर्भाशय ग्रीवा कैंसर और जननांग मस्सों के विकास से सम्बंधित हैं। अक्टूबर 2007 को बाजार में केवल दो HPV टीके उपलब्ध थे गर्दासिल और सर्वारिक्स. [168] एक हैपेटाइटिस B वेक्सीन भी है, जो हैपेटाइटिस B से वायरस से होने वाले संक्रमण को रोकती है, यह वायरस एक संक्रामक कारक है जो यकृत कैंसर का कारण है।[83] एक केनायन मेलेनोमा वेक्सीन का भी विकास किया गया है।[84][85]
स्क्रीनिंग[संपादित करें]
| इस लेख में सन्दर्भ या स्रोत नहीं दिया गया है। कृपया विश्वसनीय सन्दर्भ या स्रोत जोड़कर इस लेख में सुधार करें। स्रोतहीन सामग्री ज्ञानकोश के उपयुक्त नहीं है। इसे हटाया जा सकता है। (May 2009) स्रोत खोजें: "कर्कट रोग" – समाचार · अखबार पुरालेख · किताबें · विद्वान · जेस्टोर (JSTOR) |
कैंसर स्क्रीनिंग एक प्रयास है जो लक्षण हीन आबादी में शंकाहीन कैंसर की जांच के लिए किया जाता है। बड़ी संख्या में स्वस्थ लोगों के लिए उपयुक्त स्क्रीनिंग टेस्ट अपेक्षाकृत सस्ते, सुरक्षित होने चाहिए, इनकी प्रक्रिया संक्रामक नहीं होनी चाहिए, सकारात्मक झूठे परिणाम की दर बहुत कम होनी चाहिए। अगर कैंसर के लक्षण पता लगते हैं, तो निदान को सुनिश्चित करने के लिए अधिक निश्चित परीक्षण किए जाते हैं।
कैंसर के लिए स्क्रीनिंग विशेष मामलों में प्रारंभी निदान में सहायक है। शीघ्र निदान जीवन को बढ़ा सकता है, लेकिन आभासी रूप से मृत्यु तक के समय को सीसा समय पूर्वाग्रह या लंबाई समय पूर्वाग्रह के माध्यम से लंबा खींच सकता है।
भिन्न दुर्दमताओं के लिए कई विभिन्न स्क्रीनिंग परीक्षणों का विकास किया गया है। स्तन कैंसर स्क्रीनिंग को स्तन स्वयं परीक्षा, के द्वारा किया जा सकता है, यद्यपि 2005 में किए गए एक अध्ययन में 300,000 से अधिक चीनी महिलाओं में यह दृष्टिकोण गलत साबित हुआ।
मैमोग्राम के द्वारा स्तन कैंसर की स्क्रीनिंग एक जनसंख्या में स्तन कैंसर के निदान की औसत अवस्था को कम करती है। मेमोग्रफिक स्क्रीनिंग कार्यक्रम की शुरूआत के बाद के दस वर्षों के भीतर एक देश में निदान की अवस्था में कमी आयी है।
बड़ी-आँत मलाशय के कैंसर को फेकल ओकल्ट रक्त परीक्षण और कोलोनोस्कोपी के द्वारा जांचा जा सकता है, जो बड़ी आँत के कैंसर और मृत्यु दर दोनों को कम करता है, पूर्व दुर्दम पोलिप की जांच करके और उसे हटाकर ऐसा संभव है। इसी प्रकार, गर्भाशय ग्रीवा का कोशिका विज्ञान परीक्षण (पैप स्मीयर का उपयोग करते हुए) पूर्व कैंसर घाव की पहचान में मदद करता है। समय के साथ, ऐसे परीक्षणों के कारण गर्भाशय ग्रीवा कैंसर की घटनाओं और मृत्यु दर में कमी आयी है। 15 वर्ष की आयु में शुरुआत में शुक्र ग्रंथि कैंसर की जांच के लिए शुक्र ग्रंथि स्वयं परीक्षा की सलाह दी जाती है। प्रोस्टेट कैंसर की स्क्रीनिंग डिजिटल गुदा परीक्षा के साथ प्रोस्टेट विशिष्ट प्रतिजन (PSA) रक्त परीक्षण, का उपयोग करके की जा सकती है, हालांकि कुछ अधिकारिक संस्थाएं (जैसे यू एस प्रिवेंटिव सर्विसेज टास्क फोर्स) सभी पुरुषों में ऐसी स्क्रीनिंग के ख़िलाफ़ हैं।
कैंसर के लिए स्क्रीनिंग कई मामलों में विवाद का विषय है, जब तक यह पता न हो कि परीक्षण वास्तव में जीवन को बचायेगा.विवाद और अधिक बढ़ जाता है जब यह स्पष्ट न हो कि स्क्रीनिंग के लाभ नैदानिक परीक्षणों और कैंसर के उपचारों के संभावी जोखिम से अधिक प्रभावी हैं। उदाहरण के लिए: प्रोस्टेट कैंसर की स्क्रीनिंग के समय, PSA परीक्षण छोटे कैंसरों को पता लगा सकता है, जो कभी भी जीवन के लिए घातक नहीं बनते, लेकिन एक बार पता चल जाने पर उपचार शुरू करना ही होता है। यह स्थिति अति निदान कहलाती है, जो पुरूष को अनावश्यक उपचार जैसे शल्य चिकित्सा और विकिरण की जटिलताओं का सामना करने के लिए मजबूर कर देती है। प्रोस्टेट कैंसर का निदान करने के लिए प्रयुक्त प्रक्रियाएं (प्रोस्टेट बायोप्सी) पार्श्व प्रभावों का कारण हो सकती हैं जिनमें रक्त प्रवाह और संक्रमण शामिल है। प्रोस्टेट कैंसर का इलाज असंयम (मूत्र के प्रवाह को नियंत्रित करने के लिए असमर्थता) और लैंगिक निष्क्रियता (इरेक्शन यानि शिश्न की उत्तेजना जो संभोग के लिए अपर्याप्त है) का कारण हो सकता है। इसी प्रकार, स्तन कैंसर के लिए, हाल ही में यह आलोचना दी गयी है कि कुछ देशों में स्तन स्क्रीनिंग कार्यक्रम समस्याओं को हल करने के बजाय बढ़ा देता है। ऐसा इसलिए है कि सामान्य जनसंख्या में महिलाओं में स्क्रीनिंग कई आभासी धनात्मक परिणाम दे सकती है, जिन्हें अग्रिम जांच की जरुरत होती है, जिसकी वजह से स्तन कैंसर के केवल एक ही मामले का पता लगाने और उसके उपचार के लिए बहुत बड़ी संख्या में महिलाओं का उपचार (या स्क्रीनिंग) किया जाता है।
एक सार्वजनिक स्वास्थ्य परिप्रेक्ष्य के अनुसार पैप स्मीयर के माध्यम से ग्रीवा कैंसर स्क्रीनिंग, अन्य सभी प्रकार के कैंसर की तुलना में कीमत की दृष्टि से अधिक लाभकारी है, यह बड़े पैमाने पर एक वायरस के कारण होता है, इसमें स्पष्ट जोखिम कारक (यौन संपर्क) हैं, इस कैंसर के प्राकृतिक प्रसार का तरीका यह है कि यह सामान्यतया धीरे धीरे कई वर्षों में फैलता है, इसलिए स्क्रीनिंग कार्यक्रम को इसे जल्दी पकड़ में ले लेने के लिए अधिक समय मिल जाता है। इसके अलावा, परीक्षण अपने आप में सस्ता और बहुत ही आसान है।
इन्हीं कारणों से, कैंसर स्क्रीनिंग के लिए विचार करते समय नैदानिक प्रक्रिया और उपचार के लाभ तथा जोखिम पर ध्यान देना महत्वपूर्ण है।
स्पष्ट लक्षणों के अभाव युक्त लोगों में कैंसर के लिए मेडिकल इमेजिंग का उपयोग, समान रूप से समस्या जनक है। हाल ही में खोजे गए इन्सीडेनटालोमा की जांच में बहुत जोखिम है- एक सौम्य घाव जिसे दुर्दम समझा जा सकता है और हो सकता है कि इसके लिए सम्भावित खतरनाक जांच की जाए.
धूम्रपान करने वालों में फेफड़ों के कैंसर के लिए सीटी स्कैन-आधारित स्क्रीनिंग के हाल ही में किये गए अध्ययन के गोलमोल परिणाम सामने आये हैं, जुलाई 2007 से व्यवस्थित स्क्रीनिंग की सलाह नहीं दी जाती है। सादे-फिल्म के छाती के एक्स रे के यद्रिच्चिक नैदानिक परीक्षण, जो धूम्रपान करने वालों में फेफड़ों के कैंसर के लिए स्क्रीन करते हैं, इस दृष्टिकोण के लिए लाभकारी साबित नहीं हुए हैं।
कैनाइन कैंसर की जाँच के सटीक परिणाम होते हैं, लेकिन यह अभी भी अनुसंधान के प्रारंभिक चरण में है।
निदान[संपादित करें]
अधिकांश कैंसर या तो अपने लक्षणों और संकेतों के द्वारा प्रारंभिक रूप से पहचाने जाते हैं या स्क्रीनिंग के दौरान प्रकट होते हैं। इनमें से कोई भी निश्चित निदान नहीं है, जिसे आम तौर पर एक रोगविज्ञानी की सलाह की जरुरत होती है, यह रोग विज्ञानी एक प्रकार का फिजिशियन (मेडिकल डॉक्टर) होना चाहिए जो कैंसर और अन्य रोगों के निदान में माहिर है।
जांच[संपादित करें]

जिन लोगों में कैंसर का संदेह होता है उनकी चिकित्सा परीक्षण के द्वारा जांच की जाती है। इसमें सामान्य हैं रक्त परीक्षण, एक्स किरण, सीटी स्कैन और अंतःदर्शन (एंडोस्कोपी).
बायोप्सी[संपादित करें]
कई कारणों से कैंसर का संदेह हो सकता है, लेकिन अधिकांश दुर्दमताओं का निश्चित निदान एक रोग विज्ञानी के द्वारा कैंसर की कोशिकाओं के उतक वैज्ञानिक परीक्षण के द्वारा सुनिश्चित किया जाना चाहिए।
बायोप्सी या शल्य चिकित्सा के द्वारा उतक को प्राप्त किया जा सकता है। कई बायोप्सी (जैसे त्वचा, स्तन या यकृत की) एक चिकित्सक के कार्यालय में ही की जा सकती हैं। अन्य अंगों की बायोप्सी एक निश्चेतक की उपस्थिति में की जाती है, इसके लिए शल्य चिकित्सा के कक्ष में शल्य क्रिया की आवश्यकता होती है।
रोग विज्ञानी के द्वारा दिए गए उतक निदान प्रचुरोद्भवन करने वाली कोशिका के प्रकार को बताते हैं। साथ ही गाँठ की उतक वैज्ञानिक श्रेणी, आनुवंशिक असामान्यताओं और अन्य लक्षणों को भी स्पष्ट करते हैं।
साथ ही, यह जानकारी रोगी के पूर्व निदान का मूल्यांकन करने में तथा सर्वोत्तम इलाज का चयन करने में उपयोगी है।कोशिका आनुवंशिकी और प्रतिरक्षा उतक रसायन विज्ञान परीक्षण के अन्य प्रकार हैं जो एक रोग विज्ञानी एक उतक के नमूने पर कर सकता है। ये परीक्षण उन आण्विक परिवर्तनों (जैसे उत्परिवर्तन, संलयन जीन और संख्यात्मक गुणसूत्री परिवर्तन) के बारे में जानकारी उपलब्ध करा सकते हैं जो कैंसर की कोशिका में हुए हैं और इस प्रकार से कैंसर के भावी व्यवहार (पूर्व निदान) और सर्वोत्तम उपचार को भी इंगित करते हैं।
उपचार[संपादित करें]
कैंसर का उपचार शल्य चिकित्सा, रसोचिकित्सा (कीमोथेरपी), विकिरण चिकित्सा, प्रतिरक्षा चिकित्सा (थेरेपी), मोनोक्लोनल एंटीबॉडी चिकित्सा या अन्य विधियों के द्वारा किया जा सकता है। थेरेपी का चयन गाँठ की स्थिति और श्रेणी तथा रोग की अवस्था पर निर्भर करता है, साथ ही रोगी की सामान्य अवस्था पर भी निर्भर करता है (प्रदर्शन की स्थिति).कई प्रयोगात्मक कैंसर उपचार भी विकसित हो रहे हैं।
शरीर को नुकसान पहुचाये बिना कैंसर को पूरी तरह से ख़त्म करना उपचार का उद्देश्य होता है। कभी कभी इसे शल्य चिकित्सा के द्वारा किया जा सकता है, लेकिन कैंसर की आस-पास के उतकों पर आक्रमण करने की प्रवृति या सूक्ष्म मेटास्टेसिस द्वारा दूर के स्थानों पर फ़ैल जाने की प्रवृति अक्सर इसकी प्रभाविता को सीमित कर देती है। कीमोथेरपी की प्रभावशीलता अक्सर शरीर में अन्य उतकों के विषिकरण के द्वारा सीमित हो जाती है। विकिरण सामान्य ऊतकों को भी नुकसान पहुँचा सकते हैं।
क्योंकि "कैंसर" का सन्दर्भ रोगों के एक वर्ग से है, ऐसा सम्भव नहीं है कि "कैंसर का हमेशा एक मात्र उपचार" ही रहेगा, फिर भी सभी संक्रामक रोगों के लिए एक ही उपचार होता है।
शल्य चिकित्सा[संपादित करें]
सैद्धांतिक रूप से गैर हिमेटोलोजिकल कैंसर का इलाज किया जा सकता है यदि इसे पूरी तरह से शल्य चिकित्सा के द्वारा हटा दिया जाए, [तथ्य वांछित] लेकिन यह सदा सम्भव नहीं है। जब कैंसर शल्य चिकित्सा से पहले ही मेटास्टेसिस के द्वारा शरीर के अन्य अंगों तक पहुँच जाता है, तब पूरी तरह से शल्य क्रिया द्वारा इसे हटा देना आम तौर पर असंभव होता है। कैंसर की प्रगति के हाल्सटेड नमूने में, गाँठ स्थानिक रूप से बढती है, फ़िर लसिका पर्वों तक फ़ैल जाती है और फ़िर शरीर के अन्य सभी भागों में.इसी कारण से छोटे कैंसरों के लिए स्थानिक उपचार जैसे शल्य चिकित्सा की लोकप्रियता बढ़ गई है। यहाँ तक कि छोटे स्थानीयकृत ट्यूमर में भी मेटास्टेसिस की बहुत अधिक क्षमता होती है।
कैंसर के लिए शल्यचिकित्सा की प्रक्रियाओं के उदाहरणों में शामिल हैं- स्तन कैंसर के लिए स्तनोछेदन (स्तन को काट कर हटा देना) और प्रोस्टेट कैंसर के लिए प्रोस्टेट-छेदन (प्रोस्टेट को काट कर हटा देना). शल्य चिकित्सा का लक्ष्य होता है या तो केवल गाँठ को हटाना या पूरे अंग को निकाल देना.एक कैंसर कोशिका नग्न आंखों के लिए अदृश्य होती है, लेकिन फ़िर से वृद्धि कर के नयी गाँठ बना सकती है, यह प्रक्रिया पुनरावृत्ति कहलाती है। इस कारण के लिए, रोगविज्ञानी शल्य क्रिया से निकाले गए नमूने की जांच करते हैं, यदि स्वस्थ उतक की सीमा उपस्थित है, तो इस बात की संभावना कम हो जाती है कि सूक्ष्म कैंसर की कोशिकायें रोगी के शरीर में रह गई हैं।
प्राथमिक गाँठ को निकालने के अलावा, अक्सर शल्य क्रिया अवस्था निर्धारण के लिए आवश्यक होती है उदाहरण रोग की सीमा का निर्धारण और इस बात का निर्धारण कि यह मेटास्टेसिस के द्वारा क्षेत्रीय लसिका पर्वों तक पहुँच गया है या नहीं। अवस्था निर्धारण पूर्व निदान का मुख्य निर्धारक है और सहयोगी चिकित्सा की आवश्यकता भी है।
अक्सर, मेरु रज्जू संपीड़न या आंत्र बाधा जैसे लक्षणों को नियंत्रित करने के लिए शल्य चिकित्सा जरुरी होती है। इसे शमन उपचार के रूप में जाना जाता है।
विकिरण चिकित्सा[संपादित करें]
विकिरण चिकित्सा (रेडियोथेरेपी, एक्स रे चिकित्सा, विकिर्णन भी कहलाती है) में कैंसर की कोशिकाओं और संकुचित गांठ को नष्ट करने के लिए आयनीकरण विकिरण का उपयोग किया जाता है। विकिरण चिकित्सा को बाह्य किरण रेडियोथेरेपी के द्वारा बाहर से ही नियंत्रित किया जाता है या ब्रेकीथेरेपी के द्वारा अन्दर से नियंत्रित किया जा सकता है। विकिरण चिकित्सा का प्रभाव स्थानीकृत होता है और चिकित्सा किए जाने वाले क्षेत्र तक ही सीमित रहता है। विकिरण चिकित्सा, इलाज किए जाने वाले क्षेत्र ("लक्ष्य ऊतक") की कोशिकाओं को क्षतिग्रस्त करती है या नष्ट कर देती है, इस क्रिया में इन कोशिकाओं के आनुवंशिक पदार्थ को नष्ट कर दिया जाता है ताकि कोशिकाओं में आगे विभाजन और वृद्धि न हो पाए.यद्यपि विकिरण कैंसर की कोशिकाओं और सामान्य कोशिकाओं दोनों को नष्ट कर देते हैं, अधिकांश सामान्य कोशिकाएं विकिरण के प्रभाव से उबर आती हैं और ठीक प्रकार से कार्य करने लगती हैं। विकिरण चिकित्सा का लक्ष्य है अधिक से अधिक कैंसर कोशिकाओं को नष्ट करना, जबकि आस-पास के स्वस्थ उतकों को होने वाले नुकसान को सीमित करना। इसलिए, यह कई भागों में दी जाती है जिससे बीच की अवधि में स्वस्थ उतकों को ठीक होने का मौका मिल जाता है।
विकिरण चिकित्सा, का उपयोग लगभग हर प्रकार की ठोस गांठ के उपचार के लिए किया जा सकता है, जिसमें मस्तिष्क, स्तन, गर्भाशय ग्रीवा, गला, फेफड़े, अग्न्याशय, प्रोस्टेट, त्वचा, पेट, गर्भाशय, या कोमल उतक सार्कोमा के कैंसर शामिल हैं। ल्यूकेमिया (रक्त केंसर) और लिम्फोमा के उपचार में भी विकिरण चिकित्सा का उपयोग किया जा सकता है। प्रत्येक साइट के लिए विकिरण की खुराक कई कारकों पर निर्भर करती है, ये कारक हैं, हर प्रकार के कैंसर की रेडियो संवेदनशीलता और आस-पास के उतक या अंग विकिरण से नष्ट हो सकते हैं या नहीं। इस प्रकार, हर प्रकार के उपचार में, विकिरण चिकित्सा इसके पार्श्व दुष्प्रभावों के बिना नहीं है।
रसोचिकित्सा[संपादित करें]
रसोचिकित्सा (कीमोथेरेपी) में उन दवाओं से कैंसर का उपचार किया जाता है ("कैंसर विरोधी दवाएं") जो कैंसर की कोशिकाओं को नष्ट कर सकती हैं। वर्तमान उपयोग में, शब्द "रसोचिकित्सा" का उपयोग उन साइटोटोक्सिक या कोशिकाविषी दवाओं के लिए किया जाता है जो लक्षित चिकित्सा के विपरीत, सामान्य रूप में तेज़ी से विभाजित होती हुई कोशिकाओं को प्रभावित करती हैं। (नीचे देखें). रसोचिकित्सा दवाएं भिन्न संभव तरीकों से कोशिका विभाजन में बाधा डालती हैं, उदाहरण DNA (डीएनए) की प्रतिकृति से या नव निर्मित गुणसूत्रों के पृथक्करण से.कीमोथेरेपी के अधिकांश रूप तेज़ी से विभाजित होती हुई सभी कोशिकाओं को लक्ष्य बनाते हैं, ये केवल कर्कट की कोशिकाओं के लिए विशिष्ट नहीं हैं, यद्यपि कुछ विशिष्टता इस वजह से आ जाती है कि अधिकांश कर्कट की कोशिकाएं डीएनए क्षति की मरम्मत में सक्षम नहीं होती हैं जबकि सामान्य कोशिकाओं में आम तौर पर पर ये क्षमता होती है। अतः, रसोचिकित्सा में स्वस्थ उतकों को नुकसान पहुंचाने की क्षमता होती है, विशेष रूप से वे उतक जिनमें उच्च प्रतिस्थापन दर होती है (उदाहरण आंत का आंतरिक स्तर).ये कोशिकाएं आमतौर पर रसोचिकित्सा के बाद अपनी मरम्मत कर लेती हैं।
क्योंकि कुछ दवाएं अकेले की तुलना में एक साथ बेहतर कार्य करती हैं, इसलिए एक ही समय पर दो या अधिक दवाएं दी जाती हैं। इसे "संयोजन रसोचिकित्सा" कहा जाता है; अधिकांश रसोचिकित्सा रेजिमेन एक संयोजन में ही दिए जाते हैं।
कुछ प्रकार के ल्यूकेमिया (रक्त कैंसर) और लसीकार्बुद (लिंफोमा) के उपचार के लिए कीमोथेरपी की उच्च खुराक की या पूरे शरीर के विकीर्णन (TBI) की आवश्यकता होती है। यह उपचार अस्थि मज्जा को अलग कर देता है और इसलिए शरीर की ठीक होने और रक्त के पुनर्निमाण की क्षमता पृथक्कृत हो जाती है। इस कारण से, थेरेपी के पृथक्करण प्रभाव से पहले अस्थि मज्जा, या परिधीय रक्त स्तम्भ कोशिका हार्वेस्टिंग की जाती है ताकि उपचार के बाद "बचाव" संभव हो।
इसे ऑटोलॉगस स्टेम कोशिका प्रत्यारोपण के रूप में जाना जाता है। वैकल्पिक रूप से, एक मिलान किए गए असंबंधित दाता से ली गयी हिमेटोपोयटिक स्टेम कोशिकाएं प्रत्यारोपित की जा सकती हैं।
लक्षित चिकित्सा[संपादित करें]
लक्षित थेरेपी जो 1990 के दशक के अंत में सबसे पहले उपलब्ध हुई, का कई प्रकार के कैंसर के उपचार में मुख्य प्रभाव था और वर्तमान में यह एक बहुत ही अधिक सक्रिय अनुसंधान क्षेत्र है। इसमें ऐसे कारकों का उपयोग शामिल है जो कैंसर कोशिकाओं के प्रोटीन को अनियमित करने के लिए विशिष्टीकृत होते हैं। छोटे अणु लक्षित उपचार दवायें आमतौर पर कैंसर कोशिकाओं के भीतर उत्परिवर्तित, अति अभिव्यक्त, या अन्य जटिल प्रोटीनों पर एन्जाइमेटिक डोमेन की संदमक होती हैं।
प्रमुख उदाहरण हैं थायरोसिन कायनेज संदमक इमातिनिब (Gleevec/Glivec) और जेफितिनिब (Iressa).
मोनोक्लोनल प्रतिरक्षी चिकित्सा एक अन्य रणनीति है जिसमें उपचार का कारक एक प्रतिरक्षी होता है जो कैंसर कोशिकाओं की सतह पर एक प्रोटीन के साथ विशेष रूप से बंध बना लेता है। उदाहरणों में शामिल हैं स्तन कैंसर में प्रयुक्त किया जाने वाला एंटी- HER2/neu प्रतिरक्षी ट्रास्टूज़ुमेब (हरसेपटिन) और कई प्रकार की B-कोशिका दुर्दमताओं में प्रयुक्त किया जाने वाला एंटी CD-20 प्रतिरक्षी रितुक्सिमेब.
लक्षित थेरेपी में "होमिंग युक्ति" के रूप में छोटे पेप्टाइड भी शामिल हो सकते हैं, जो गाँठ के चारों ओर प्रभावित बाह्य कोशिकी मैट्रिक्स के साथ या कोशिका की सतह पर ग्राही के साथ बांध बना सकते हैं।
रेडियो न्युक्लीड जो इन पेपटाईडों (उदाहरण RGD) से जुड़े होते हैं, अंततः कैंसर कोशिका को मार देते हैं यदि न्यूक्लीड कोशिका के आस पास अपघटित हो रहा है।
विशेष रूप से इन बंधित पदार्थों के ओलिगो- या मल्टीमर्स बहुत महत्वपूर्ण होते हैं, चूँकि वे गाँठ की विशिष्टता और उत्कंठा को बढ़ाते हैं।
प्रकाश गतिक चिकित्सा (PDT) कैंसर के लिए तिहरा उपचार है जिसमें प्रकाश संवेदक, उतक ऑक्सीजन, ओर प्रकाश (अक्सर लेजर का उपयोग) शामिल हैं। PDT का उपयोग आधारी कोशिका कार्सिनोमा (BCC) या फेफड़ों के कैंसर के उपचार के लिए किया जाता है; PDT बड़े ट्यूमर को शल्य चिकित्सा के द्वारा हटा दिए जाने के बाद दुर्दम उतक के बचे हुए अवशेषों को हटाने में भी उपयोगी हो सकता है।[86]
प्रतिरक्षा चिकित्सा[संपादित करें]

कैंसर प्रतिरक्षा थेरेपी भिन्न चिकित्सा रणनीतियों का एक समूह है जिसे रोगी के अपने प्रतिरक्षा तंत्र को प्रेरित करने के लिए डिजाइन किया गया है ताकि वह गाँठ से लड़ सके। गाँठ के खिलाफ प्रतिरक्षी प्रतिक्रिया उत्पन्न करने के लिए कई विधियां हैं, ये हैं, सतही मुत्राश्यी कैंसर के लिए अंतर धानीय BCG प्रतिरक्षा चिकित्सा, तथा वृक्क कोशिका कार्सिनोमा और मेलानोमा के रोगियों में प्रतिरक्षी प्रतिक्रिया प्रेरित करने के लिए इंटरफेरोन और अन्य साइटोकाइन का उपयोग. कई प्रकार की गांठों, खास तौर पर दुर्दम मेलानोमा और वृक्क कोशिका कार्सिनोमा, के लिए विशिष्ट प्रतिरक्षा प्रतिक्रिया उत्पन्न करने के लिए वेक्सीनों पर गहन अनुसंधान किया जा रहा है।
सीपुल्यूकल-T प्रोस्टेट कैंसर के लिए आधुनिक नैदानिक परीक्षणों में एक वेक्सीन की तरह की रणनीति है, जिसमें रोगी से ली गयी द्रुमाश्मी कोशिकाओं को प्रोस्टेटिक अम्ल फोस्फेटेज पेप्टाइड्स के साथ लोड किया जाता है, ताकि प्रोस्टेट-व्युत्पन्न कोशिकाओं के खिलाफ विशेष प्रतिरक्षा प्रतिक्रिया को प्रेरित किया जा सके।
एल्लोजिनेनिक हिमेटोपोयटिक स्टेम कोशिका प्रत्यारोपण (आनुवंशिक रूप से असमान दाता से "अस्थि-मज्जा स्थानान्तरण") को प्रतिरक्षा थेरेपी का एक रूप माना जा सकता है, क्योंकि दाता की प्रतिरक्षा कोशिकाएं ग्राफ्ट-बनाम-गाँठ प्रभाव के तहत गाँठ पर अक्सर आक्रमण करती हैं। इसीलिए, एल्लोजिनेनिक HSCT, कई प्रकार के कैंसर के लिए ऑटोलॉगस प्रत्यारोपण की तुलना में उपचार की उच्च दर का कारण बनती है, यद्यपि पार्श्व दुष्प्रभाव भी अधिक गंभीर होते हैं।
हार्मोन थेरेपी (हार्मोन चिकित्सा)[संपादित करें]
कुछ कैंसर की वृद्धि को विशेष होर्मोनों को उपलब्ध करा कर या अवरुद्ध करके संदमित किया जा सकता है। हार्मोन संवेदी गांठों के कुछ सामान्य उदाहरण हैं- विशेष प्रकार के स्तन और प्रोस्टेट कैंसर.एस्ट्रोजन या टेस्टोस्टेरोन को हटा देना या अवरुद्ध कर देना अक्सर एक महत्वपूर्ण अतिरिक्त उपचार है। विशेष प्रकार के कैंसरों में, हार्मोन का प्रशासन शिथिल हो जाता है, जैसे प्रोजेसटोजन चिकित्सा की दृष्टि से लाभकारी हो सकता है।
वाहिकाजनन संदमक[संपादित करें]
वाहिकाजनन (एंजियोजिनेसिस संदमक रक्त वाहिनियों की व्यापक वृद्धि को रोकता है (एंजियोजिनेसिस) जो ट्यूमर को जीवित रहने के लिए जरुरी है। कुछ, जैसे बेवासीज़ुमेब, को मान्यता दे दी गयी है और चिकित्सकीय उपयोग में इनका उपयोग किया जा रहा है। एन्जियोजिनेसिस विरोधी दवाओं के साथ एक मुख्य समस्या यह है कि कई कारक सामान्य और कैंसर युक्त कोशिकाओं में रक्त वाहिनियों की वृद्धि को उत्तेजित करते हैं। एंजियोजिनेसिस विरोधी दवाये केवल एक ही कारक को लक्ष्य बनाती हैं, इसलिए अन्य कारक रक्त वाहिनी की वृद्धि को उत्तेजित करना जारी रखते हैं। अन्य समस्याओं में शामिल हैं प्रशासन का मार्ग, स्थिरता का रख-रखाव और ट्यूमर वाहिका संरचना पर क्रिया और लक्ष्यीकरण.[87]
लक्षण नियंत्रण[संपादित करें]
यद्यपि कैंसर के लक्षणों पर नियंत्रण को कैंसर का उपचार नहीं माना जा सकता है, यह कैंसर रोगियों की जीवन की गुणवत्ता का एक महत्वपूर्ण निर्धारक है और इस फैसले में मुख्य भूमिका निभाता है कि रोगी अन्य उपचार के लिए सक्षम है या नहीं। हालांकि डॉक्टरों के पास, कैंसर के रोगियों में दर्द, मतली, उल्टी, डायरिया, रक्तस्राव और अन्य आम समस्याओं को कम करने के लिए चिकित्सकीय कौशल होता है, रोगियों के इस समूह की लक्षण नियंत्रण की आवश्यकताओं के लिए प्रतिक्रिया में प्रशामक देखभाल की बहुल अनुशासनात्मक विशेषता का विकास हुआ है।
दर्द की दवाये, जैसे कि मोर्फीन और ओक्सिकोडोन और मिचली और उल्टी को रोकने के लिए एंटीएमेटिक्स दवाएं, कैंसर से सम्बंधित लक्षणों से युक्त रोगियों में आम तौर पर काम में ली जाती हैं। परिष्कृत एंटीएमेटिक्स जैसे ओन्देनसेट्रोन और ऐनालोग्युस, साथ ही एप्रेपिटेन्ट ने कैंसर रोगियों में उग्र उपचार को अधिक सम्भव बना दिया है।
कैन्सर के कारण पुराना दर्द हमेशा सतत उतक क्षति के कारण होता है जो रोग या उपचार प्रक्रिया से सम्बंधित है (यानी शल्य चिकित्सा, रेडिएशन, कीमोथेरपी) यद्यपि पर्यावरणीय कारकों और दर्द के व्यवहार के उत्पादन में प्रभावी गडबडी की भी भूमिका होती है, कैंसर के दर्द से युक्त रोगियों में आम तौर पर प्रमुख इटियोलोजिक कारण नहीं होते हैं। इसके अलावा, कैंसर से सम्बंधित भयंकर दर्द से युक्त अधिकांश रोगी अपने जीवन की अंतिम अवस्था में होते हैं और उन्हें प्रशामक चिकित्सा की जरुरत होती है।
मुद्दे जैसे नशीले पदार्थों के उपयोग का सामाजिक कलंक, काम और कार्यात्मक स्थिति और स्वास्थ्य देखभाल, समग्र मामले के प्रबंधन में अधिक महत्वपूर्ण नहीं हैं। अतः, कैंसर दर्द प्रबंधन के लिए विशिष्ट रणनीति है नशीले पदार्थों और अन्य दवाओं, शल्य चिकित्सा और भौतिक तरीकों के उपयोग के द्वारा रोगी को अधिक से अधिक आराम पहुँचने की कोशिश करना। डॉक्टर कैंसर के अन्तिम स्थिति के रोगियों में दर्द के लिए मादक पदार्थों का उपयोग नहीं करना चाहते हैं क्यों कि इससे उन्हें इसकी लत हो सकती है या उनकी श्वास क्रिया में बाधा आ सकती है।प्रशामक देखभाल, देखभाल आंदोलन की एक नई शाखा है जो कैंसर के रोगियों में दर्द के उपचार में अधिक व्यापक सहयोग प्रदान करती है।
थकान कैंसर रोगियों के लिए एक बहुत ही आम समस्या है और हाल ही में कैंसर चिकित्सा विज्ञानियों के लिए इसका उपचार बहुत महत्वपूर्ण बन गया है, यद्यपि यह कई रोगियों में जीवन की गुणवत्ता को लेकर महत्त्वपूर्ण भूमिका निभाता है।
उपचार के प्रयास[संपादित करें]
नैदानिक परीक्षण, जो अनुसंधान अध्ययन भी कहलाते हैं, कैंसर के रोगियों में नए उपचारों का परीक्षण भी करते हैं। इस शोध का लक्ष्य है कैंसर के इलाज के लिए बेहतर तरीके खोजना और कैंसर रोगियों की मदद करना। नैदानिक परीक्षण कई प्रकार के उपचारों का परीक्षण करते हैं जैसे नयी दवाएं, सर्जरी या विकिरण चिकित्सा के नए दृष्टिकोण, उपचार के नए संयोजन, या नई विधियां जैसे जीन थेरेपी.
एक नैदानिक परीक्षण, एक लम्बी और सतर्क कैंसर अनुसंधान की प्रक्रिया के अंतिम चरणों में से एक है। नए उपचार के लिए खोज प्रयोगशाला में शुरू होती है, जहाँ वैज्ञानिक पहले नए विचारों का परीक्षण और विकास करते हैं। अगर एक दृष्टिकोण उपयोगी प्रतीत होता है तो अगला कदम होता है इसका जानवर पर परीक्षण, जो यह बताता है कि कैंसर रोगी पर इसका क्या प्रभाव होगा और इसके कोई हानिकारक प्रभाव हैं या नहीं। बेशक, कई उपचार जो प्रयोगशाला में या पशुओं में अच्छी तरह से काम करते हैं, वे हमेशा मनुष्य में कारगर साबित नहीं होते हैं। उपयोगी माने जाने वाले उपचार सुरक्षित और प्रभावी हैं या नहीं, इसका पता लगाने के लिए कैंसर के रोगियों में अध्ययन किये जाते हैं।
हो सकता है कि जो रोगी इसमें भाग ले रहा है उसे इस उपचार से व्यक्तिगत रूप से मदद मिले। वे कैंसर विशेषज्ञों से आधुनिकतम सुरक्षा प्राप्त करते हैं और वे या तो जांच किया जा रहा नया इलाज प्राप्त करते हैं या कैंसर के लिए सर्वोत्तम उपलब्ध मानक उपचार प्राप्त करते हैं। साथ ही, नए उपचारों में अज्ञात जोखिम भी हो सकते हैं, लेकिन यदि नए उपचार प्रभावी या मानक उपचारों से अधिक प्रभावी साबित होते हैं, तो अध्ययन किया जाने वाला रोगी इसके लाभ को प्राप्त करने वाला पहला व्यक्ति बन जाता है। इस बात की कोई गारंटी नहीं है कि परीक्षण किया जाने वाला नया उपचार या एक मानक उपचार अच्छे परिणाम देगा। कैंसर युक्त बच्चों में, एक सर्वेक्षण से पता चलता है कि जिन बच्चों पर ऐसे परीक्षण किया गए उनमें औसतन मानक उपचारों की तुलना में बेहतर या बुरे परिणाम नहीं देखे गए; इससे यह सुनिश्चित होता है कि किसी भी प्रयोगात्मक उपचार की सफलता या असफलता का पूर्वानुमान नहीं लगाया जा सकता है।[88]
पूरक और वैकल्पिक[संपादित करें]
पूरक और वैकल्पिक चिकित्सा (CAM) उपचार, चिकित्सा, स्वास्थ्य रक्षा प्रणालियों, प्रथाओं और उत्पादों के विविध समूह हैं, जो पारम्परिक चिकित्सा के भाग नहीं हैं।[89] "पूरक चिकित्सा" का अर्थ उन विधियों और पदार्थों से है, जिनका उपयोग पारम्परिक चिकित्सा के साथ किया जाता है। जबकि "वैकल्पिक चिकित्सा" का अर्थ उन यौगिकों से है जिनका उपयोग पारम्परिक चिकित्सा के स्थान पर किया जाता है।[90] CAM का उपयोग कैंसर से युक्त लोगों में आम है; 2000 में किये गए एक अध्ययन में पाया गया कि 69% कैंसर रोगियों ने कम से कम एक CAM चिकित्सा का उपयोग अपने कैंसर उपचार के एक हिस्से के रूप में किया है।[91] कैंसर के लिए ज्यादातर पूरक और वैकल्पिक चिकित्साओं का कठोर अध्ययन या परीक्षण नहीं किया गया है। कुछ वैकल्पिक उपचार, जिन पर जांच की गयी है और वे निष्प्रभावी हैं, उनका लगातार विपणन हो रहा है और उन्हें प्रोत्साहन मिल रहा है।[92]
गर्भावस्था में[संपादित करें]
गर्भवती माताओं की बढ़ती हुई उम्र के कारण गर्भावस्था के दौरान समवर्ती कैंसर की घटनाओं में वृद्धि हुई है,[93] इन घटनाओं में वृद्धि का एक और कारण है जन्म पूर्व अल्ट्रासाउंड परीक्षणों के दौरान प्रासंगिक रूप से माता में गाँठ की जांच.
मां और उसके भ्रूण/बच्चे दोनों को कम से कम नुकसान पहुंचे, इसके लिए कैंसर उपचार को चयनित करने की आवश्यकता है। कई मामलों में एक चिकित्सीय गर्भपात की सलाह दी जा सकती है।
विकिरण चिकित्सा पर आमतौर पर कोई सवाल नहीं उठाये जाते हैं और रसायन चिकित्सा (कीमो थेरेपी) में हमेशा गर्भपात और जन्मजात विरूपताओं का ख़तरा बना रहता है।[93] बच्चे पर चिकित्सा के प्रभावों के बारे में बहुत कम ज्ञात है।
यहाँ तक कि एक दवा जिस पर परीक्षण किया गया है कि यह अपरा (प्लेसंटा) से होकर बच्चे तक नहीं पहुंचती है, कैंसर के कुछ रूप अपरा को नुकसान पहुंचा सकते हैं और दवा इसमें से होकर चली जाती है।[93] त्वचा कैंसर के कुछ रूप मेटास्टेसिस के द्वारा बच्चे के शरीर में भी प्रवेश कर सकते हैं।[93]
निदान भी ज्यादा कठिन हो गया है, चूंकि इसकी उच्च विकिरण खुराक की वजह से कमप्युटेड टोमोग्राफी अव्यवहार्य है। फिर भी, चुंबकीय अनुनाद इमेजिंग सामान्य रूप से काम करता है।[93] हालांकि विपरीत मीडिया का उपयोग नहीं किया जा सकता है, चूंकि वे अपरा को पार कर जाते हैं।[93]
गर्भावस्था के दौरान कैंसर के ठीक प्रकार से निदान और उपचार में आने वाली कठिनाइयों के एक परिणाम के रूप में, वैकल्पिक तरीकों का इस्तमाल किया जाता है, इसमें या तो अधिक उग्र कैंसर उपचार शुरू करने के लिए एक सीजेरियन सेक्शन का उपयोग किया जाता है या यदि कैंसर इतना अधिक दुर्दम हो चुका है कि मां के इलाज में और देरी नहीं की जा सकती है तो कैंसर का उपचार करने के लिए गर्भपात कर दिया जाता है।[93]
गर्भाशये (इन युट्रो)[संपादित करें]
कभी कभी गर्भाशय में रहते हुए ही भ्रूणीय गांठों का निदान किया जाता है। टेराटोमा भ्रूण ट्यूमर का सबसे आम प्रकार है और आमतौर पर सौम्य होता है।
पूर्व निदान[संपादित करें]
कैंसर को एक घातक रोग के रूप में जाना जाता है। हालांकि यह बात निश्चित रूप से विशेष प्रकारों पर ही लागू होती है, कैंसर के ऐतिहासिक तथ्यों के पीछे छुपी हुई सच्चाई चिकित्सा क्षेत्र में आधुनिकीकरण के कारण बदल गई है। कैंसर के कुछ प्रकारों में ऐसे लक्षण पाए गए हैं, जो कुछ अदुर्दम रोगों जैसे हृदय का असफल होना और हृदय आघात से बेहतर हैं।
प्रगतिशील और तेजी से फैलते हुए दुर्दम रोग का कैंसर रोगी के जीवन की गुणवत्ता पर काफी प्रभाव पड़ता है और कई कैंसर उपचार (जैसे कीमोथेरपी) के गंभीर पार्श्व दुष्प्रभाव हो सकते हैं। कैंसर के उन्नत चरणों में, कई रोगियों को व्यापक देखभाल की जरुरत होती है, यह उसके परिवार के सदस्यों और मित्रों को प्रभावित करता है।प्रशामक देखभाल समाधान में स्थायी या "राहत" धर्मशाला नर्सिंग शामिल हो सकती है।
भावनात्मक प्रभाव[संपादित करें]
कई स्थानीय संगठन कैंसर रोगियों के लिए कई प्रकार की व्यावहारिक सहायतायें और सेवाएं उपलब्ध कराते हैं। ये सेवाएं हैं सहायता समूह, परामर्श, सलाह, वित्तीय सहायता, उपचार के स्थान से और वहाँ तक परिवहन, कैंसर के बारे में जानकारी या फिल्में.अस-पास के संगठनों, स्थानीय स्वास्थ्य सेवा प्रदाताओं, या क्षेत्र के अस्पतालों में संसाधन या सेवाएं उपलब्ध हो सकती हैं।
परामर्श कैंसर रोगियों को भावनात्मक सहारा प्रदान कर सकता है, उन्हें अपनी बीमारी समझने में मदद करता है। भिन्न प्रकार के परामर्श मेंशामिल हैं व्यक्तिगत, समूह, परिवार, साथियों के परामर्श, वियोग, रोगी-से-रोगी का परामर्श और कामुकता.
रोगियों को कैंसर से निपटने में मदद करने के लिए कई कई सरकारी और धर्मार्थ संगठन स्थापित किए गए हैं। ये संगठन अक्सर कैंसर की रोकथाम, कैंसर के उपचार और कैंसर अनुसंधान में रत रहते हैं।
महामारी विज्ञान[संपादित करें]
कैंसर अमेरिका में सभी मौतों में से 25% के लिए जिम्मेदार है और दुनिया के कई भागों में एक प्रमुख सार्वजनिक स्वास्थ्य समस्या है। अमेरिका में, फेफड़ों का कैंसर, कैंसर मौतों में से 30% का कारण है, लेकिन यह कैंसर के नए मामलों का केवल 15% होता है; पुरुषों में सबसे सामान्य रूप से पाया जाने वाल कैंसर है प्रोस्टेट कैंसर (नए मामलों का लगभग 25%) और महिलाओं में सबसे सामान्य रूप से पाया जाने वाला कैंसर है स्तन कैंसर (यह भी लगभग 25% है).
कैंसर छोटे बच्चों और किशोरों में भी हो सकता है, लेकिन ऐसा कम ही होता है (अमेरिका में प्रति मिलियन में लगभग 150 मामले), इसमें रक्त कैंसर (ल्यूकेमिया) सबसे आम है।[94] अमेरिका में जीवन के पहले वर्ष में प्रति मिलियन मामलों में 230 ऎसी घटनाएं होती हैं, जिनमें सबसे सामान्य है न्यूरोब्लास्टोमा.[95]
दुनिया भर में कैंसर मौतों का एक तिहाई संभावित संशोधन योग्य जोखिम कारकों के कारण होता है। जिसमें मुख्य हैं, तम्बाकू धुम्रपान, शराब का उपयोग और आहार में फल और सब्जियों का कम उपभोग. विकसित देशों में अधिक वजन और मोटापा भी कैंसर का एक प्रमुख कारण है और निम्न और माध्यम आय वर्ग वाले देशों में मानव पेपिलोमा वायरस का लैंगिक संचरण ग्रीवा कैंसर के लिए मुख्य जोखिम कारक है।[42]
इतिहास[संपादित करें]

वर्तमान में उपकला उतक से व्युत्पन्न एक दुर्दम गाँठ के लिए चिकित्सकीय शब्द के रूप में ग्रीक शब्द कार्सिनोमा का उपयोग किया जाता है। सेल्सस ने कार्सिनोज का लेटिन में अनुवाद करके शब्द दिया कैंसर, जिसका अर्थ केकडा भी है। गेलन ने सभी गांठों का वर्णन करने के लिए "ओंकोज " का प्रयोग किया, जो आधुनिक शब्द ओन्कोलोजी का मूल है।[96]
हिप्पोक्रेट्स ने कई प्रकार के कैंसर का वर्णन किया। उन्होंने सौम्य ट्यूमर को ओंकोस कहा, जिसका अर्थ ग्रीक में सूजन से है और दुर्दम ट्यूमर को उन्होंने कार्सिनोज कहा जिसका अर्थ ग्रीक में केकडा या क्रेफिश है।
यह नाम एक ठोस घातक ट्यूमर की कटी हुई सतह के कारण उत्पन्न हुआ है, "जिसके चारों और शिराएँ फैली हुई हैं, यह केकड़े के पैरों की तरह दिखती हैं, जिससे इसे यह नाम मिला है"[97] (चित्र देखें) बाद में उन्होंने प्रत्यय -ओमा जोड़ा, यूनानी में इसका अर्थ है सूजन और इस प्रकार से इसका नाम कार्सिनोमा हो गया। चूंकि शरीर को खोलना यूनानी परम्परा के खिलाफ था, हिप्पोक्रेट्स ने त्वचा, नाक और स्तन पर बाहर से दिखाई देने वाले ट्यूमरों का ही वर्णन किया और उनके चित्र बनाये। उपचार चार शारीरिक द्रव्यों (काले और पीले पित्त, रक्त और कफ) के ह्यूमर सिद्धांत पर आधारित था। रोगी के भाव के अनुसार, इलाज के के लिए आहार, रक्त और/या जुलाब काम में लिया जाता था। सदियों के दौरान यह ज्ञात हो गया कि कैंसर शरीर के किसी भी भाग में हो सकता है, लेकिन ह्यूमर सिद्धांत पर आधारित उपचार 19 वीं सदी तक लोकप्रिय बना रहा जब कोशिकाओं की खोज की गयी।
हमारे प्राचीनतम वर्णन और कैंसर के सर्जिकल उपचार की खोज मिस्र में लगभग 1600 ई.पू. की गयी। पेपाइरस ने स्तन के 8 अल्सर के मामलों का वर्णन किया जिनका ईलाज "अग्नि ड्रिल" नमक उपकरण की सहायता से दागने के द्वारा किया गया।
इस बीमारी के बारे में लेखन कहता है, "इसका कोई इलाज नहीं है।"[98]
कैंसर के लिए अन्य प्रारंभिक शल्य चिकित्सा का वर्णन 1020 में अविसन्ना (इब्न सीना) के द्वारा दी केनन ऑफ़ मेडिसिन में किया गया। उन्होंने कहा कि छंटाई ठीक प्रकार से होनी चाहिए और सम्पूर्ण रोग युक्त उतक को हटा देना चाहिए, इसमें विच्छेदन का उपयोग या ट्यूमर की दिशा में जाने वाली शिराओं को हटाना शामिल है। उन्होंने सलाह दी कि जरुरत पड़ने पर प्रभावित क्षेत्र के लिए दागने की क्रिया का उपयोग भी किया जा सकता है।[99]
16 वीं और 17 वीं शताब्दियों में, मृत्यु के कारण को खोजने के लिए शरीर को काटना डॉक्टरों के लिए अधिक स्वीकार्य बन गया। जर्मन प्रोफेसर विल्हेम फेब्री का मानना था कि स्तन कैंसर एक स्तन वाहिनी में दूध के थक्के के कारण होता है। डेसकार्टेस के एक अनुयायी डच प्राध्यापक फ्रेंकोसिस डे ला बोए सिल्वियस का मानना था कि सभी बीमारियां रासायनिक प्रक्रिया का परिणाम हैं और अम्लीय लसिका द्रव्य कैंसर का कारण है।
उसके समकालीन निकोलस टल्प का मानना था कि कैंसर एक जहर है जो धीरे धीरे फैलता है और उन्होंने निष्कर्ष निकाला कि यह संक्रामक है।[100]
कैंसर का पहला ऐसा कारण ब्रिटिश शल्य चिकित्सक पेर्किवल पोट के द्वारा पहचाना गया, जिसने 1775 में खोज की कि चिमनी की सफाई में संलग्न लोगों में अंडकोश का कैंसर आम है। अन्य व्यक्तिगत चिकित्सकों के कार्य ने कई दृष्टिकोण विकसित किए, लेकिन जब चिकित्सकों ने एक साथ काम करना शुरू किया तब वे ठोस निष्कर्ष पर पहुँच सके।
18 वीं सदी में सूक्ष्मदर्शी के व्यापक उपयोग से यह ज्ञात हुआ कि 'कैंसर का ज़हर' अपने प्राथमिक ट्यूमर से अन्य स्थानों तक लिम्फ पर्वों के माध्यम से फैलता है ("मेटास्टेसिस").इस रोग का यह दृष्टिकोण सबसे पहले अंग्रेजी शल्य चिकित्सक कैम्पबेल डी मॉर्गन ने 1871 और 1874 के बीच दिया। [101] स्वच्छता की समस्या के कारण कैंसर का इलाज करने के लिए शल्य चिकित्सा का इस्तेमाल करने के परिणाम अच्छे नहीं रहे। मशहूर स्कॉटलैंड के शल्य चिकित्सक अलेक्जेंडर मोनरो ने दो साल में शल्य चिकित्सा के बाद जीवित साठ मरीजों में से केवल दो में स्तन ट्यूमर को देखा.19 वीं सदी में, असेप्सिस ने शल्य चिकित्सा में स्वच्छता की दृष्टि से सुधार किया और इससे जीवित रहने के आँकड़ों में वृद्धि हुई, शल्य चिकित्सा कैंसर का प्रारंभिक उपचार बन गया।विलियम काले अपवाद थे जिन्होंने 1800 के अंत में पाया कि असेप्सिस से पहले शल्य चिकित्सा के बाद उपचार की दर अधिक थी, (और उन्होंने मिश्रित परिणामों के साथ ट्यूमर में जीवाणु को इंजेक्ट कर दिया), कैंसर का उपचार शल्य चिकित्सक की ट्यूमर को हटाने की कला पर निर्भर हो गया। इसी अवधि के दौरान, यह पता लगा कि शरीर कई ऊतकों से बना है जो कई मिलियन कोशिकाओं से बने हैं, इस विचार से शरीर में रासायनिक असंतुलन के बारे में ह्यूमर सिद्धांतों ने जन्म लिया।कोशिका विकृतिविज्ञान के युग का जन्म हुआ।
जब 19 वीं सदी के अंत में, मेरी क्युरी और पियरे क्युरी ने विकिरण की खोज की, उन्होंने कैंसर के लिए पहला प्रभावी शल्य चिकित्सा हीन उपचार खोजा.विकिरण के साथ कैंसर के उपचार के लिए बहुल अनुशासनात्मक दृष्टिकोण के पहले लक्षण प्रकट हुए. शल्य चिकित्सक अब सिर्फ़ ऑपरेशन नहीं करते हैं, लेकिन विकिरण विज्ञानी के साथ मिलकर कार्य करते हैं और रोगी की मदद करते हैं। इससे संचार में जटिलताएं आयीं, साथ ही घर के बजाय रोगी के उपचार की जरुरत अस्पताल में महसूस हुई, साथ ही अस्पताल की फाइलों में रोगी से सम्बंधित आंकडों को संकलित किया गया। जिससे पहली बार सांख्यिकीय रोगी अध्ययन की शुरुआत हुई।
जनेत लेन-क्लेपोन की खोज को प्रकाशित किया गया, जिन्होंने 1926 में ब्रिटिश स्वास्थ्य मंत्रालय के लिए जीवन शैली और समान पृष्ठ भूमि के 500 नियंत्रित रोगियों और 500 स्तन कैंसर के मामलों के एक तुलनात्मक अध्ययन का प्रकाशन किया। कैंसर महामारी विज्ञान पर उनके जबरदस्त कार्य को रिचर्ड डोल और ऑस्टिन ब्राडफोर्ड हिल के द्वारा आगे बढाया गया, जिन्होंने "फेफड़ों के कैंसर और धूम्रपान से सम्बंधित मृत्यु के अन्य कारणों को प्रकाशित किया। अमरत्व पर ब्रिटिश डॉक्टरों की दूसरी रिपोर्ट"1956 में दी गई (अन्यथा ब्रिटिश डॉक्टरों का अध्ययन कहलाता है।) रिचर्ड डोल ने 1968 में ऑक्सफ़ोर्ड कैन्सर महामारी विज्ञान ईकाई को शुरू करने के लिए लन्दन चिकित्सा अनुसंधान केन्द्र को छोड़ दिया। कंप्यूटर के उपयोग के साथ, यह पहली ईकाई थी जिसने बड़ी मात्रा में कैंसर पर आंकडों का संकलन किया। आधुनिक महामारी विज्ञान विधियां सार्वजनिक स्वास्थ्य नीति और रोगों की वर्तमान अवधारणाओं से निकट सम्बंधित हैं। पिछले 50 वर्षों से, चिकित्सा अभ्यास, अस्पताल, प्रांतीय, राज्य और यहाँ तक कि देश की सीमाओं, अदि पर आंकडे एकत्रित करने के लिए बहुत अधिक प्रयास किए गए हैं, साथ ही इस बात पर भी ध्यान दिया गया है कि पर्यावरण और सांस्कृतिक कारक कैंसर की घटना को कैसे प्रभावित करते हैं।
द्वितीय विश्व युद्घ तक एक चिकित्सक को व्यक्तिगत रूप से कैंसर रोगी के उपचार और अध्ययन करने की अनुमति नहीं थी, अब चिकित्सा अनुसंधान केन्द्रों ने खोजा कि रोग की घटना में काफी अंतर्राष्ट्रीय अन्तर दिखाई देते हैं। इस अंतर्दृष्टि के कारण राष्ट्रीय सार्वजनिक स्वास्थ्य निकायों ने अस्पतालों और क्लीनिकों में स्वास्थ्य सम्बन्धी आंकडों को संकलित किया, यह एक ऐसी प्रक्रिया थी जिसे आज कई देश करते हैं। जापानी मेडिकल समुदाय ने प्रेक्षित किया कि हिरोशिमा और नागासाकी के परमाणु विस्फोटों के शिकार लोगों का अस्थि मज्जा पूरी तरह से नष्ट हो गया था। उन्होंने निष्कर्ष निकाला कि रोगग्रस्त अस्थि मज्जा को भी विकिरण के द्वारा नष्ट किया जा सकता है और इससे रक्त कैंसर (ल्यूकेमिया) के लिए अस्थि मज्जा प्रत्यारोपण की खोज हुई। द्वितीय विश्व युद्घ के बाद से कैंसर उपचार की प्रवृतियों में सुधार हो रहे हैं, इसमें उपस्थित उपचार विधियों में सूक्ष्म स्तर पर सुधार हुआ है, उनका मानकीकरण किया गया है और महामारी विज्ञान और अंतरराष्ट्रीय साझेदारी के माध्यम से इलाज के तरीके की खोज में उन्हें वैश्वीकृत किया गया है।
अनुसंधान निर्देश[संपादित करें]
कैंसर अनुसंधान एक गहन वैज्ञानिक प्रयास है जो रोग प्रक्रियाओं को समझने के लिए और संभव उपचार की खोज के लिए किया जाता है। कैंसर अनुसंधान के कारण आण्विक जीव विज्ञान और कोशिका जीव विज्ञान के ज्ञान के बढ़ने से कैंसर के कई नए प्रभावी उपचारों की खोज हुई है। ऐसा तब से हुआ जब से 1971 में राष्ट्रपति निक्सन ने "कैंसर पर युद्ध" की घोषणा की। संयुक्त राज्य अमेरिका ने 1971 के बाद से कैंसर अनुसंधान पर 200 बिलियन डॉलर से अधिक का निवेश किया है; यह धन सार्वजनिक और निजी क्षेत्रों के द्वारा और संस्थाओं के द्वारा लगाया गया है।[102] इस भारी निवेश के बावजूद, 1950 और 2005 के बीच देश की कैंसर से मृत्यु दर में केवल एक पाँच प्रतिशत की कमी देखी गई है (आबादी के आकार और आयु के लिए समायोजन करते हुए).[103]
अग्रणी कैंसर अनुसंधान संगठनों और परियोजनाओं में शामिल हैं अमेरिकन एसोसिएशन फॉर कैंसर रिसर्च, अमेरिकन कैंसर सोसायटी (ACS), दी अमेरिकन सोसाइटी ऑफ़ क्लिनिकल ओन्कोलोजी, दी यूरोपियन ओर्गनाइजेशन फॉर रिसर्च एंड ट्रीटमेंट ऑफ़ कैंसर, राष्ट्रीय कैंसर संस्थान, नेशनल कोम्प्रिहेन्सिव कैंसर नेटवर्क और दी कैंसर जीनोम एटलस प्रोजेक्ट NCI में,पोस्ट ग्रेजुएट इन्सटिट्यूट ऑफ मेडिकल इडूकेशन एण्ड रिसर्च चण्डीगढ भारत, राजीव गाँधी कैन्सर इंस्टिट्यूट एण्ड रिसर्च सेन्टर रोहणी दिल्ली।
सन्दर्भ[संपादित करें]
- ↑ Cancer Research UK (2007). "UK cancer incidence statistics by age". मूल से 18 अगस्त 2012 को पुरालेखित. अभिगमन तिथि 2007-06-25.
- ↑ WHO (2006). "Cancer". World Health Organization. अभिगमन तिथि 2007-06-25. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ American Cancer Society (2007). "Report sees 7.6 million global 2007 cancer deaths". Reuters. अभिगमन तिथि 2008-08-07. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Kinzler, Kenneth W.; Vogelstein, Bert (2002). "Introduction". The genetic basis of human cancer (2nd, illustrated, revised संस्करण). New York: McGraw-Hill, Medical Pub. Division. पृ॰ 5. आई॰ऍस॰बी॰ऍन॰ 978-0-07-137050-9.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ https://www.cancer.gov/types
- ↑ Nelson DA, Tan TT, Rabson AB, Anderson D, Degenhardt K, White E (2004). "Hypoxia and defective apoptosis drive genomic instability and tumorigenesis". Genes & Development. 18 (17): 2095–107. PMID 15314031. डीओआइ:10.1101/gad.1204904. पी॰एम॰सी॰ 515288. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद);|access-date=दिए जाने पर|url= भी दिया जाना चाहिए(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Merlo LM, Pepper JW, Reid BJ, Maley CC (2006). "Cancer as an evolutionary and ecological process". Nat. Rev. Cancer. 6 (12): 924–35. PMID 17109012. डीओआइ:10.1038/nrc2013. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ अ आ Sasco AJ, Secretan MB, Straif K (2004). "Tobacco smoking and cancer: a brief review of recent epidemiological evidence". Lung cancer (Amsterdam, Netherlands). 45 Suppl 2: S3–9. PMID 15552776. डीओआइ:10.1016/j.lungcan.2004.07.998. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Biesalski HK, Bueno de Mesquita B, Chesson A; एवं अन्य (1998). "European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel". CA: a cancer journal for clinicians. 48 (3): 167–76, discussion 164–6. PMID 9594919. डीओआइ:10.3322/canjclin.48.3.167. Explicit use of et al. in:
|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)[मृत कड़ियाँ] - ↑ O'Reilly KM, Mclaughlin AM, Beckett WS, Sime PJ (2007). "Asbestos-related lung disease". American family physician. 75 (5): 683–8. PMID 17375514. मूल से 29 सितंबर 2007 को पुरालेखित. अभिगमन तिथि 15 दिसंबर 2009. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Seitz HK, Pöschl G, Simanowski UA (1998). "Alcohol and cancer". Recent developments in alcoholism : an official publication of the American Medical Society on Alcoholism, the Research Society on Alcoholism, and the National Council on Alcoholism. 14: 67–95. PMID 9751943.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Kuper H, Boffetta P, Adami HO (2002). "Tobacco use and cancer causation: association by tumour type". Journal of internal medicine. 252 (3): 206–24. PMID 12270001. डीओआइ:10.1046/j.1365-2796.2002.01022.x. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ अ आ Kuper H, Adami HO, Boffetta P (2002). "Tobacco use, cancer causation and public health impact". Journal of internal medicine. 251 (6): 455–66. PMID 12028500. डीओआइ:10.1046/j.1365-2796.2002.00993.x. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Proctor RN (2004). "The global smoking epidemic: a history and status report". Clinical lung cancer. 5 (6): 371–6. PMID 15217537. डीओआइ:10.3816/CLC.2004.n.016. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ English DR, Armstrong BK, Kricker A, Fleming C (1997). "Sunlight and cancer". Cancer causes & control : CCC. 8 (3): 271–83. PMID 9498892. डीओआइ:10.1023/A:1018440801577. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Feychting M, Ahlbom A, Kheifets L (2005). "EMF and health". Annual review of public health. 26: 165–89. PMID 15760285. डीओआइ:10.1146/annurev.publhealth.26.021304.144445.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ कैंसर विशेषज्ञ सेलफोन पर कर्मचारियों को चेतावनी देते हैं Archived 2008-12-17 at the वेबैक मशीन, CNN, 23 जुलाई 2008
- ↑ Pagano JS, Blaser M, Buendia MA; एवं अन्य (2004). "Infectious agents and cancer: criteria for a causal relation". Semin. Cancer Biol. 14 (6): 453–71. PMID 15489139. डीओआइ:10.1016/j.semcancer.2004.06.009. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद); Explicit use of et al. in:|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ zur Hausen H (1991). "Viruses in human cancers". Science. 254 (5035): 1167–73. PMID 1659743. डीओआइ:10.1126/science.1659743.
- ↑ Peter S, Beglinger C (2007). "Helicobacter pylori and gastric cancer: the causal relationship". Digestion. 75 (1): 25–35. PMID 17429205. डीओआइ:10.1159/000101564.
- ↑ Wang C, Yuan Y, Hunt RH (2007). "The association between Helicobacter pylori infection and early gastric cancer: a meta-analysis". Am. J. Gastroenterol. 102 (8): 1789–98. PMID 17521398. डीओआइ:10.1111/j.1572-0241.2007.01335.x. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Cheung TK, Xia HH, Wong BC (2007). "Helicobacter pylori eradication for gastric cancer prevention". J. Gastroenterol. 42 Suppl 17: 10–5. PMID 17238019. डीओआइ:10.1007/s00535-006-1939-2. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Habibzadeh, Parham; Dastsooz, Hassan; Eshraghi, Mehdi; Łos, Marek J.; Klionsky, Daniel J.; Ghavami, Saeid (2021-01). "Autophagy: The Potential Link between SARS-CoV-2 and Cancer". Cancers (अंग्रेज़ी में). 13 (22): 5721. आइ॰एस॰एस॰एन॰ 2072-6694. डीओआइ:10.3390/cancers13225721.
|date=में तिथि प्राचल का मान जाँचें (मदद) - ↑ Wood C, Harrington W (2005). "AIDS and associated malignancies". Cell Res. 15 (11–12): 947–52. PMID 16354573. डीओआइ:10.1038/sj.cr.7290372.
- ↑ Mellemkjaer L, Hammarstrom L, Andersen V; एवं अन्य (2002). "Cancer risk among patients with IgA deficiency or common variable immunodeficiency and their relatives: a combined Danish and Swedish study". Clin. Exp. Immunol. 130 (3): 495–500. PMID 12452841. डीओआइ:10.1046/j.1365-2249.2002.02004.x. Explicit use of et al. in:
|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ अ आ Tolar J, Neglia JP (2003). "Transplacental and other routes of cancer transmission between individuals". J Pediatr Hematol Oncol. 25 (6): 430–4. PMID 12794519. डीओआइ:10.1097/00043426-200306000-00002. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Dingli D, Nowak MA (2006). "Cancer biology: infectious tumour cells". Nature. 443 (7107): 35–6. PMID 16957717. डीओआइ:10.1038/443035a. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ "Cancer Spread By Transplantation Extremely Rare: In Very Rare Case, Woman Develops Leukemia from Liver Transplant". मूल से 15 जुलाई 2009 को पुरालेखित. अभिगमन तिथि 15 दिसंबर 2009.
- ↑ "The Nobel Prize in Physiology or Medicine 1980".
- ↑ Murgia C, Pritchard JK, Kim SY, Fassati A, Weiss RA (2006). "Clonal origin and evolution of a transmissible cancer". Cell. 126 (3): 477–87. PMID 16901782. डीओआइ:10.1016/j.cell.2006.05.051.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Croce CM (2008). "Oncogenes and cancer". The New England journal of medicine. 358 (5): 502–11. PMID 18234754. डीओआइ:10.1056/NEJMra072367. मूल से 12 फ़रवरी 2010 को पुरालेखित. अभिगमन तिथि 15 दिसंबर 2009. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Knudson AG (2001). "Two genetic hits (more or less) to cancer". Nature reviews. Cancer. 1 (2): 157–62. PMID 11905807. डीओआइ:10.1038/35101031. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Bos JL (1989). "ras oncogenes in human cancer: a review". Cancer Research. 49 (17): 4682–9. PMID 2547513. अभिगमन तिथि 2009-06-06. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Chang EH, Furth ME, Scolnick EM, Lowy DR (1982). "Tumorigenic transformation of mammalian cells induced by a normal human gene homologous to the oncogene of Harvey murine sarcoma virus". Nature. 297 (5866): 479–83. PMID 6283358. डीओआइ:10.1038/297479a0.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Matoba S, Kang J, Patino W, Wragg A, Boehm M, Gavrilova O, Hurley P, Bunz F, Hwang P (2006). "p53 regulates mitochondrial respiration". Science. 312 (5780): 1650–3. PMID 16728594. डीओआइ:10.1126/science.1126863.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Knudson A (1971). "Mutation and cancer: statistical study of retinoblastoma". Proc Natl Acad Sci USA. 68 (4): 820–3. PMID 5279523. डीओआइ:10.1073/pnas.68.4.820.
- ↑ Fodde R, Smits R (2002). "Cancer biology. A matter of dosage". Science. 298 (5594): 761–3. PMID 12399571. डीओआइ:10.1126/science.1077707.
- ↑ Nowell PC (1976). "The clonal evolution of tumor cell populations". Science. 194 (4260): 23–8. PMID 959840. डीओआइ:10.1126/science.959840. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Merlo LM, Pepper JW, Reid BJ, Maley CC (2006). "Cancer as an evolutionary and ecological process". Nat Rev Cancer. 6 (12): 924–35. PMID 17109012. डीओआइ:10.1038/nrc2013. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Hanahan D, Weinberg RA (2000). "The hallmarks of cancer". Cell. 100 (1): 57–70. PMID 10647931. डीओआइ:10.1016/S0092-8674(00)81683-9.
- ↑ Cho RW, Clarke MF (2008). "Recent advances in cancer stem cells". Curr. Opin. Genet. Dev. 18 (1): 48–53. PMID 18356041. डीओआइ:10.1016/j.gde.2008.01.017. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ अ आ Danaei G, Vander Hoorn S, Lopez AD, Murray CJ, Ezzati M (2005). "Causes of cancer in the world: comparative risk assessment of nine behavioural and environmental risk factors". Lancet. 366 (9499): 1784–93. PMID 16298215. डीओआइ:10.1016/S0140-6736(05)67725-2.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ "Lung Cancer in American Women: Facts". मूल से 9 जुलाई 2007 को पुरालेखित. अभिगमन तिथि 2007-01-19.
- ↑ अ आ इ World Health Organization (2007-04-27). WHO calls for prevention of cancer through healthy workplaces. प्रेस रिलीज़. http://www.who.int/mediacentre/news/notes/2007/np19/en/index.html. अभिगमन तिथि: 2007-10-13.
- ↑ "National Institute for Occupational Safety and Health- Occupational Cancer". United States National Institute for Occupational Safety and Health. अभिगमन तिथि 2007-10-13.
- ↑ Buell P, Dunn JE (1965). "Cancer mortality among Japanese Issei and Nisei of California". Cancer. 18: 656–64. PMID 14278899. डीओआइ:10.1002/1097-0142(196505)18:5<656::AID-CNCR2820180515>3.0.CO;2-3.
- ↑ Slattery ML, Boucher KM, Caan BJ, Potter JD, Ma KN (1998). "Eating patterns and risk of colon cancer". Am. J. Epidemiol. 148 (1): 4–16. PMID 9663397.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Larsson SC, Wolk A (2007). "Coffee consumption and risk of liver cancer: a meta-analysis". Gastroenterology. 132 (5): 1740–5. PMID 17484871. डीओआइ:10.1053/j.gastro.2007.03.044.
- ↑ अ आ Ward MH, Sinha R, Heineman EF; एवं अन्य (1997). "Risk of adenocarcinoma of the stomach and esophagus with meat cooking method and doneness preference". Int. J. Cancer. 71 (1): 14–9. PMID 9096659. डीओआइ:10.1002/(SICI)1097-0215(19970328)71:1<14::AID-IJC4>3.0.CO;2-6. Explicit use of et al. in:
|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Sinha R, Peters U, Cross AJ; एवं अन्य (2005). "Meat, meat cooking methods and preservation, and risk for colorectal adenoma". Cancer Res. 65 (17): 8034–41. PMID 16140978. Explicit use of et al. in:
|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Steck SE, Gaudet MM, Eng SM; एवं अन्य (2007). "Cooked meat and risk of breast cancer--lifetime versus recent dietary intake". Epidemiology (Cambridge, Mass.). 18 (3): 373–82. PMID 17435448. डीओआइ:10.1097/01.ede.0000259968.11151.06. Explicit use of et al. in:
|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Anderson KE, Kadlubar FF, Kulldorff M; एवं अन्य (2005). "Dietary intake of heterocyclic amines and benzo(a)pyrene: associations with pancreatic cancer". Cancer Epidemiol. Biomarkers Prev. 14 (9): 2261–5. PMID 16172241. डीओआइ:10.1158/1055-9965.EPI-04-0514. Explicit use of et al. in:
|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Ornish D; एवं अन्य (2005). "Intensive lifestyle changes may affect the progression of prostate cancer". The Journal of Urology. 174 (3): 1065–9, discussion 1069–70. PMID 16094059. डीओआइ:10.1097/01.ju.0000169487.49018.73. Explicit use of et al. in:
|author=(मदद) - ↑ Chlebowski RT, Blackburn GL, Thomson CA; एवं अन्य (2006). "Dietary fat reduction and breast cancer outcome: interim efficacy results from the Women's Intervention Nutrition Study". J. Natl. Cancer Inst. 98 (24): 1767–76. PMID 17179478. डीओआइ:10.1093/jnci/djj494. Explicit use of et al. in:
|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Romieu I, Lazcano-Ponce E, Sanchez-Zamorano LM, Willett W, Hernandez-Avila M (2004). "Carbohydrates and the risk of breast cancer among Mexican women". Cancer Epidemiol Biomarkers Prev. 13 (8): 1283–9. PMID 15298947. नामालूम प्राचल
|day=की उपेक्षा की गयी (मदद); नामालूम प्राचल|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Francesca Bravi, Cristina Bosetti, Lorenza Scotti, Renato Talamini, Maurizio Montella, Valerio Ramazzotti, Eva Negri, Silvia Franceschi, and Carlo La Vecchia (2006). "Food Groups and Renal Cell Carcinoma: A Case-Control Study from Italy". International Journal of Cancer. 355:1991-2002. डीओआइ:10.1002/ijc.22225. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)[मृत कड़ियाँ] - ↑ Jee SH, Ohrr H, Sull JW, Yun JE, Ji M, Samet JM (2005). "Fasting serum glucose level and cancer risk in Korean men and women". JAMA. 293 (2): 194–202. PMID 15644546. डीओआइ:10.1001/jama.293.2.194.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Michaud DS, Liu S, Giovannucci E, Willett WC, Colditz GA, Fuchs CS (2002). "Dietary sugar, glycemic load, and pancreatic cancer risk in a prospective study". J Natl Cancer Inst. 94 (17): 1293–300. PMID 12208894. डीओआइ:10.1093/jnci/94.17.1293.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Venkateswaran V, Haddad AQ, Fleshner NE; एवं अन्य (2007). "Association of diet-induced hyperinsulinemia with accelerated growth of prostate cancer (LNCaP) xenografts". J Natl Cancer Inst. 99 (23): 1793–800. PMID 18042933. डीओआइ:10.1093/jnci/djm231. Explicit use of et al. in:
|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ [128] ^ फ्रिएबे, रिचर्ड: क्या एक उच्च वसा युक्त आहार कैंसर से लड़ने में मदद करता है? Archived 2009-02-20 at the वेबैक मशीन टाइम मैगजीन, सितम्बर 17, 2007
- ↑ [129] ^ हित्ती, मिरांडा: उच्च रक्त शर्करा लिंक कैंसर के खतरे से सम्बंधित है WebMD, 22 फ़रवरी 2008
- ↑ मोयनिहन, टिमोथी: कैंसर के कारण: कैंसर के कारणों के बारे में लोकप्रिय मिथक, MayoClinic.com, 22 फ़रवरी 2008 को पुनः प्राप्त
- ↑ [131] ^ शर्करा युक्त पेय पदार्थों से बचें Archived 2008-10-04 at the वेबैक मशीन अधिक ऊर्जा युक्त खाद्य पदार्थों का उपभोग सिमित करें Archived 2008-10-04 at the वेबैक मशीन, अमेरिकन इंस्टीट्यूट फॉर कैंसर रिसर्च, 20 फ़रवरी 2008 को संशोधित
- ↑ उच्च शर्करा के स्तर कैंसर और मृत्यु दर के जोखिम को बढ़ते हैं Archived 2008-11-30 at the वेबैक मशीन, देश का स्वास्थ्य: अमेरिकन पब्लिक हेल्थ एसोसिएशन के सरकारी समाचार पत्र, फरवरी 2005
- ↑ Kushi LH, Byers T, Doyle C; एवं अन्य (2006). "American Cancer Society Guidelines on Nutrition and Physical Activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity". CA Cancer J Clin. 56 (5): 254–81, quiz 313–4. PMID 17005596. डीओआइ:10.3322/canjclin.56.5.254. मूल से 29 नवंबर 2009 को पुरालेखित. अभिगमन तिथि 27 फ़रवरी 2009. Explicit use of et al. in:
|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ [135] ^ "ऐतिहासिक अवलोकन" Archived 2010-01-08 at the वेबैक मशीन dietandcancerreport.org. 27 अगस्त 2008 को पुनः प्राप्त.
- ↑ [136] ^ "अनुशंसाएँ". Archived 2010-01-07 at the वेबैक मशीन Dietandcancerreport.org. 27 अगस्त 2008 को पुनः प्राप्त.
- ↑ फ़ूड, न्यूट्रीशियन, फिजिकल एक्टिविटी, एंड दी प्रिवेंशन ऑफ़ कैंसर: एक वैश्विक परिप्रेक्ष्य अध्याय 12 Archived 2009-03-25 at the वेबैक मशीन विश्व कैंसर रिसर्च कोष (2007).आईएसबीएन 978-0-9722522-2-5.
- ↑ Pollan, Michael (2006). The Omnivore's Dilemma : A Natural History of Four Meals. New York: Penguin Press. पपृ॰ 450. आई॰ऍस॰बी॰ऍन॰ 978-1-59420-082-3.
- ↑ Giovannucci E, Liu Y, Rimm EB; एवं अन्य (2006). "Prospective study of predictors of vitamin D status and cancer incidence and mortality in men". J. Natl. Cancer Inst. 98 (7): 451–9. PMID 16595781. डीओआइ:10.1093/jnci/djj101. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद); Explicit use of et al. in:|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ "Vitamin D Has Role in Colon Cancer Prevention". मूल से 4 दिसंबर 2006 को पुरालेखित. अभिगमन तिथि 2007-07-27.
- ↑ Schwartz GG, Blot WJ (2006). "Vitamin D status and cancer incidence and mortality: something new under the sun". J. Natl. Cancer Inst. 98 (7): 428–30. PMID 16595770. डीओआइ:10.1093/jnci/djj127. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Grant WB (2002). "An estimate of premature cancer mortality in the U.S. due to inadequate doses of solar ultraviolet-B radiation". Cancer. 94 (6): 1867–75. PMID 11920550. डीओआइ:10.1002/cncr.10427. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Grant WB, Garland CF, Holick MF (2005). "Comparisons of estimated economic burdens due to insufficient solar ultraviolet irradiance and vitamin D and excess solar UV irradiance for the United States". Photochemistry and Photobiology. 81 (6): 1276–86. PMID 16159309. डीओआइ:10.1562/2005-01-24-RA-424.
|access-date=दिए जाने पर|url= भी दिया जाना चाहिए(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ ग्रांट डबल्यू बी, गर्लेंड सी एफ, होर्लिक एमएफ. अपर्याप्त सौर पराबैंगनी विकिर्नो९न और विटामिन D के कारन अनुमानित आर्थिक बोझ की तुलना और संयुक्त राज्य अमेरिका के लिए अतिरिक्त सौर यूवी विकिरण. फोटोकेम फोटोबायोल 2005 नवम्बर-दिसम्बर; 81 (6): 1276-86.
- ↑ "Questions and answers about beta carotene chemoprevention trials" (PDF). National Cancer Institute. 1997-06-27. मूल (PDF) से 29 सितंबर 2006 को पुरालेखित. अभिगमन तिथि 2009-04-23.
- ↑ Cole BF, Baron JA, Sandler RS; एवं अन्य (2007). "Folic acid for the prevention of colorectal adenomas: a randomized clinical trial". JAMA. 297 (21): 2351–9. PMID 17551129. डीओआइ:10.1001/jama.297.21.2351. Explicit use of et al. in:
|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ अ आ Vogel V, Costantino J, Wickerham D, Cronin W, Cecchini R, Atkins J, Bevers T, Fehrenbacher L, Pajon E, Wade J, Robidoux A, Margolese R, James J, Lippman S, Runowicz C, Ganz P, Reis S, McCaskill-Stevens W, Ford L, Jordan V, Wolmark N (2006). "Effects of tamoxifen vs raloxifene on the risk of developing invasive breast cancer and other disease outcomes: the NSABP Study of Tamoxifen and Raloxifene (STAR) P-2 trial". JAMA. 295 (23): 2727–41. PMID 16754727. डीओआइ:10.1001/jama.295.23.joc60074.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Thompson I, Goodman P, Tangen C, Lucia M, Miller G, Ford L, Lieber M, Cespedes R, Atkins J, Lippman S, Carlin S, Ryan A, Szczepanek C, Crowley J, Coltman C (2003). "The influence of finasteride on the development of prostate cancer". N Engl J Med. 349 (3): 215–24. PMID 12824459. डीओआइ:10.1056/NEJMoa030660.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Hallak A, Alon-Baron L, Shamir R, Moshkowitz M, Bulvik B, Brazowski E, Halpern Z, Arber N (2003). "Rofecoxib reduces polyp recurrence in familial polyposis". Dig Dis Sci. 48 (10): 1998–2002. PMID 14627347. डीओआइ:10.1023/A:1026130623186.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Baron J, Sandler R, Bresalier R, Quan H, Riddell R, Lanas A, Bolognese J, Oxenius B, Horgan K, Loftus S, Morton D (2006). "A randomized trial of rofecoxib for the chemoprevention of colorectal adenomas". Gastroenterology. 131 (6): 1674–82. PMID 17087947. डीओआइ:10.1053/j.gastro.2006.08.079.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Bertagnolli M, Eagle C, Zauber A, Redston M, Solomon S, Kim K, Tang J, Rosenstein R, Wittes J, Corle D, Hess T, Woloj G, Boisserie F, Anderson W, Viner J, Bagheri D, Burn J, Chung D, Dewar T, Foley T, Hoffman N, Macrae F, Pruitt R, Saltzman J, Salzberg B, Sylwestrowicz T, Gordon G, Hawk E (2006). "Celecoxib for the prevention of sporadic colorectal adenomas". N Engl J Med. 355 (9): 873–84. PMID 16943400. डीओआइ:10.1056/NEJMoa061355.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ अ आ "Cancer Vaccine Fact Sheet". NCI. 2006-06-08. मूल से 25 अक्तूबर 2008 को पुरालेखित. अभिगमन तिथि 2008-11-15.
- ↑ Liao JC, Gregor P, Wolchok JD, Orlandi F, Craft D, Leung C, Houghton AN, Bergman PJ. (2006). "Vaccination with human tyrosinase DNA induces antibody responses in dogs with advanced melanoma". Cancer Immun. 6: 8.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Animal Medical Centre (2007-03-26). USDA Grants Conditional Approval for First Therapeutic Vaccine to Treat Cancer. प्रेस रिलीज़. Archived from the original on 14 दिसंबर 2009. http://www.amcny.org/technology/melanomavaccine.aspx. अभिगमन तिथि: 2009-06-06.
- ↑ Dolmans, DE; Fukumura D, Jain RK (2003). "Photodynamic therapy for cancer". Nat Rev Cancer. 3 (5): 380–7. PMID 12724736. डीओआइ:10.1038/nrc1071. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Kleinman HK, Liau G (2001). "Gene therapy for antiangiogenesis". J. Natl. Cancer Inst. 93 (13): 965–7. PMID 11438554. डीओआइ:10.1093/jnci/93.13.965. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ Kumar A, Soares H, Wells R; एवं अन्य (2005). "Are experimental treatments for cancer in children superior to established treatments? Observational study of randomised controlled trials by the Children's Oncology Group". BMJ. 331 (7528): 1295. PMID 16299015. डीओआइ:10.1136/bmj.38628.561123.7C. पी॰एम॰सी॰ 1298846. Explicit use of et al. in:
|author=(मदद);|pages=और|page=के एक से अधिक मान दिए गए हैं (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Cassileth BR, Deng G (2004). "Complementary and alternative therapies for cancer". Oncologist. 9 (1): 80–9. PMID 14755017. डीओआइ:10.1634/theoncologist.9-1-80.
- ↑ [193] ^ CAM क्या है? पूरक और वैकल्पिक चिकित्सा के लिए राष्ट्रीय केंद्र: 3 फ़रवरी 2008 को पुनः प्राप्त.
- ↑ Richardson MA, Sanders T, Palmer JL, Greisinger A, Singletary SE (2000). "Complementary/alternative medicine use in a comprehensive cancer center and the implications for oncology". J Clin Oncol. 18 (13): 2505–14. PMID 10893280. नामालूम प्राचल
|day=की उपेक्षा की गयी (मदद); नामालूम प्राचल|month=की उपेक्षा की गयी (मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Vickers A (2004). "Alternative cancer cures: 'unproven' or 'disproven'?". CA Cancer J Clin. 54 (2): 110–8. PMID 15061600. डीओआइ:10.3322/canjclin.54.2.110. मूल से 6 दिसंबर 2010 को पुरालेखित. अभिगमन तिथि 27 फ़रवरी 2009.
- ↑ अ आ इ ई उ ऊ ए "Krebstherapie in der Schwangerschaft extrem schwierig" (जर्मन में). Curado. Associated Press. 2009-02-20. मूल से 6 मार्च 2016 को पुरालेखित. अभिगमन तिथि 2009-06-06.
- ↑ Jemal A, Siegel R, Ward E; एवं अन्य (2008). "Cancer statistics, 2008". CA Cancer J Clin. 58 (2): 71–96. PMID 18287387. डीओआइ:10.3322/CA.2007.0010. मूल से 3 जुलाई 2011 को पुरालेखित. अभिगमन तिथि 15 दिसंबर 2009. Explicit use of et al. in:
|author=(मदद)सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) - ↑ Gurney JG, Smith MA, Ross JA (1999). "Cancer among infants" (PDF). प्रकाशित Ries LAG, Smith MA, Gurney JG, Linet M, Tamra T, Young JL, Bunin GR (eds) (संपा॰). Cancer Incidence and Survival among Children and Adolescents, United States SEER program 1975–1995. NIH Pub. No 99-4649. Bethesda, MD: National Cancer Institute, SEER Program. पपृ॰ 149–56.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link) सीएस1 रखरखाव: फालतू पाठ: editors list (link)
- ↑ Karpozilos A, Pavlidis N (2004). "The treatment of cancer in Greek antiquity". Eur. J. Cancer. 40 (14): 2033–40. PMID 15341975. डीओआइ:10.1016/j.ejca.2004.04.036.
- ↑ Moss, Ralp (2004). "Galen on Cancer". CancerDecisions.
- ↑ "The History of Cancer". American Cancer Society. 2009. मूल से 2 मार्च 2010 को पुरालेखित. अभिगमन तिथि 27 फ़रवरी 2009. नामालूम प्राचल
|month=की उपेक्षा की गयी (मदद) - ↑ [219] ^ पेट्रीसिया स्किनर (2001), यूनानी-टिब्बी, वैकल्पिक चिकित्सा का विश्वकोश
- ↑ मेरिलिन यालोम "अ हिस्ट्री ऑफ़ ब्रेस्ट" 1997.न्यू यॉर्क: अल्फ्रेड ए क्नोप्फ़. आईएसबीएन 0-679-43459-3
- ↑ Grange JM, Stanford JL, Stanford CA (2002). "Campbell De Morgan's 'Observations on cancer', and their relevance today". Journal of the Royal Society of Medicine. 95 (6): 296–9. PMID 12042378. डीओआइ:10.1258/jrsm.95.6.296.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- ↑ Sharon Begley (2008-09-16). "Rethinking the War on Cancer". Newsweek. अभिगमन तिथि 2008-09-08.
- ↑ Kolata, Gina (April 23, 2009). "Advances Elusive in the Drive to Cure Cancer". दि न्यू यॉर्क टाइम्स. अभिगमन तिथि 2009-05-05. Italic or bold markup not allowed in:
|publisher=(मदद)
सामान्य सन्दर्भ[संपादित करें]
- पजदुर आर, वागमन एल डी, केम्प हसन के ऐ, होस्किंस डबल्यू जे, संस्करण. कैंसर मेनेजमेंट: अ मल्टी डिसीप्लिनेरी अप्रोच Archived 2009-05-15 at the वेबैक मशीन. ग्यारहवां संस्करण.२००९
- दी बेसिक साइंस ऑफ़ ओन्कोलोजी तेनोक आई ऍफ़, हिल आरपी एट अल (संस्करण) चौथा संस्करण 2005 मेक ग्रा हिल.आईएसबीएन 0-07138-774-9.
- प्रिंसिपल्स ऑफ़ कैंसर बायोलोजी क्लेनस्मिथ, एल जे (2006).पियर्सन बेंजामिन क्युम्मिंग्स. आईएसबीएन 0-80534-003-3.
- Parkin D, Bray F, Ferlay J, Pisani P (2005). "Global cancer statistics, 2002". CA Cancer J Clin. 55 (2): 74–108. PMID 15761078. डीओआइ:10.3322/canjclin.55.2.74. मूल से 6 जुलाई 2008 को पुरालेखित. अभिगमन तिथि 27 फ़रवरी 2009.सीएस1 रखरखाव: एक से अधिक नाम: authors list (link)
- फ़ूड, न्यूट्रीशियन, फिजिकल एक्टिविटी, एंड दी प्रिवेंशन ऑफ़ कैंसर: एक वैश्विक परिप्रेक्ष्य .विश्व कैंसर रिसर्च कोष (2007).आईएसबीएन 978-0-9722522-2-5.पूर्ण पाठ
- कैंसर मेडीसिन, छठा संस्करण पाठ्यपुस्तक
- एनसाइक्लोपीडिया ऑफ़ कैंसर चौथा खंड सन्दर्भ कार्य
- Robert A. Weinberg (1996). "How Cancer Arises; An explosion of research is uncovering the long-hidden molecular underpinnings of cancer—and suggesting new therapies" (PDF): 62–70.
Introductary explanation of cancer biology in layman's language
नामालूम प्राचल|publication=की उपेक्षा की गयी (मदद); नामालूम प्राचल|month=की उपेक्षा की गयी (मदद); Cite journal requires|journal=(मदद)
इन्हें भी देखें[संपादित करें]
- रसोचिकित्सा (कीमोथिरैपी)
- विकिरण चिकित्सा
- कण चिकित्सा (Hadron therapy या particle therapy)
== बाहरी कड़ियाँ ==््
https://www.foryogafitness.in/2021/09/Cancer-types-cause-symptoms-treatment-hindi.html Archived 2021-09-12 at the वेबैक मशीन
| Cancer से संबंधित मीडिया विकिमीडिया कॉमंस पर उपलब्ध है। |
- राष्ट्रीय कैंसर रोकथाम एवं अनुसंधान संस्थान Archived 2017-04-26 at the वेबैक मशीन
- कैंसर से जंग (विकासपीडिया)
- बुडविग कैंसर आहार चिकित्सा
- कैन्सर टाइम्स
